
108年度諾貝爾化學獎與鋰離子電池之發明
- 物理專文
- 撰文者:劉如熹、仝梓正、廖譽凱、胡淑芬
- 發文日期:2020-02-18
- 點閱次數:3048
鋰離子電池之發明迄今四十年有餘。此四十年間鋰離子電池之正極、負極與電解液之發展帶動鋰離子電池性能之提高,並使鋰離子電池廣泛應用于電動車、移動電子設備以及可再生能源發電之存儲。108年度之諾貝爾化學獎授予古迪納夫(John B. Goodenough),惠廷翰(M. Stanley Whittingham)與吉野彰(Akira Yoshino)三人以表彰他們對鋰離子電池之貢獻,亦為對鋰離子電池發展之肯定。鋰離子電池之研發涉及物理、化學、材料、工程等多領域之協作,而少有專門為鋰離子電池研發人員開設之課程,造成一般之研究人員僅關注自身研究部分之內容而少對鋰離子電池有整體之了解。本文透過介紹鋰離子電池之原理,三位諾獎得主之貢獻,鋰離子電池之應用與未來之發展以增進研發人員與普通大眾對鋰離子電池之了解。
鋰離子電池介紹
早期鋰電池因其放電電壓與電流穩定而受矚目,然鋰金屬本身活性強,無法輕易加工與保存並使用,直至20世紀才漸漸使鋰電池進入實用階段。1至此鋰電池仍為一次電池,意即其放電完即無法再使用。因於充電將導致鋰金屬枝晶(lithium dendrite)產生,此將使電池短路且再充電效率相當差。鋰離子電池(lithium-ion battery)乃將鋰電池僅可一次使用之缺點改良,而可再充電重複使用。最早即由Whittinghan教授等人2所發表於Science期刊,當時以二硫化鈦(titanium(IV) sulfide; TiS2)之高能量密度正極,搭配鋰金屬負極所製作首顆二次鋰離子電池,其可進行充電且循環壽命高。然此正極易與空氣中水氣形成劇毒氣體硫化氫(H2S),且鋰金屬本身與空氣穩定度相當低,故應用上仍具安全疑慮。
為解決高危險性之正極材料,「鋰離子電池之父」Goodenough教授等人3於1980年發表使用鈷酸鋰(lithium cobalt oxide; LiCoO2; LCO)正極與鋰金屬負極製作之鋰離子電池,其具高電位(3.6V)、高電容量密度(約274 mAh g-1)、低自放電率與循環穩定性高之優點。結構與正極半反應式如圖一所示,鈷酸鋰正極自發現以來極受最高矚目,至現今仍為商用鋰離子電池之常用正極。鋰離子電池之陰陽及定義往往因其可充放電,而易造成混淆。一般以放電為標準定義,其中正極於放電時發生還原化學反應,稱為陰極。而負極於放電時發生氧化化學反應,稱為陽極。
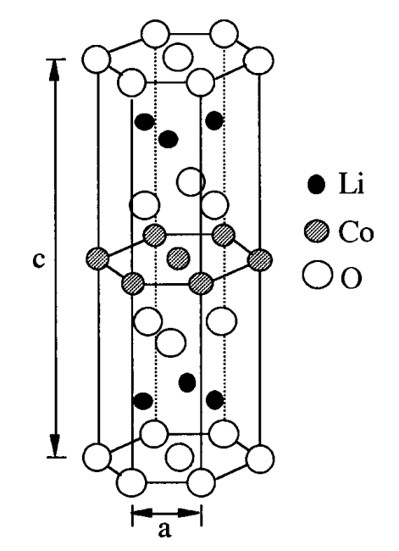
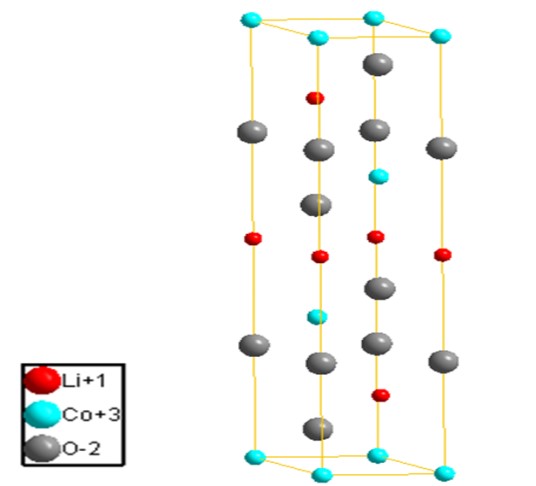
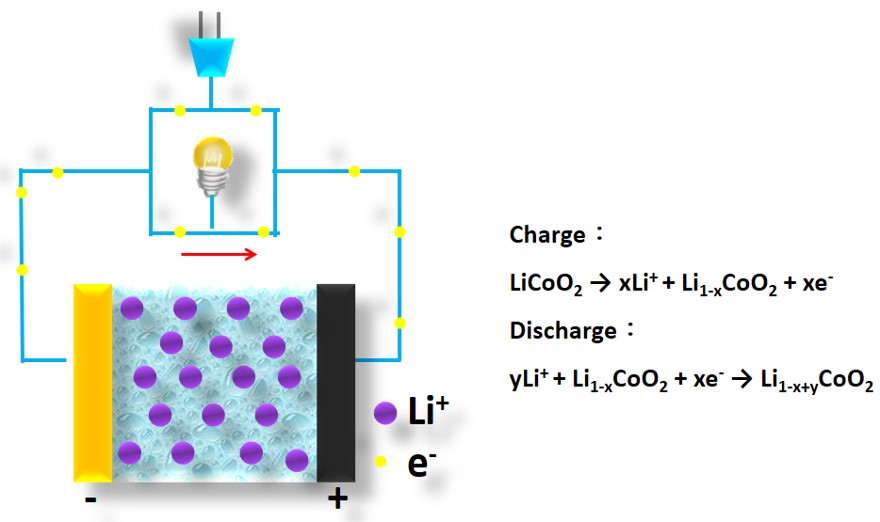
圖一 鈷酸鋰正極結構與循環半反應式示意圖。1
發展合適之鋰離子電池正負極成為爾後科學家研究之目標,圖二為各式鋰離子電池常見之正負極材料之電位與電容量關係圖。正極分為嵌入式正極與反應式正極,負極則為鋰金屬、石墨、鈦酸鋰、矽等材料。
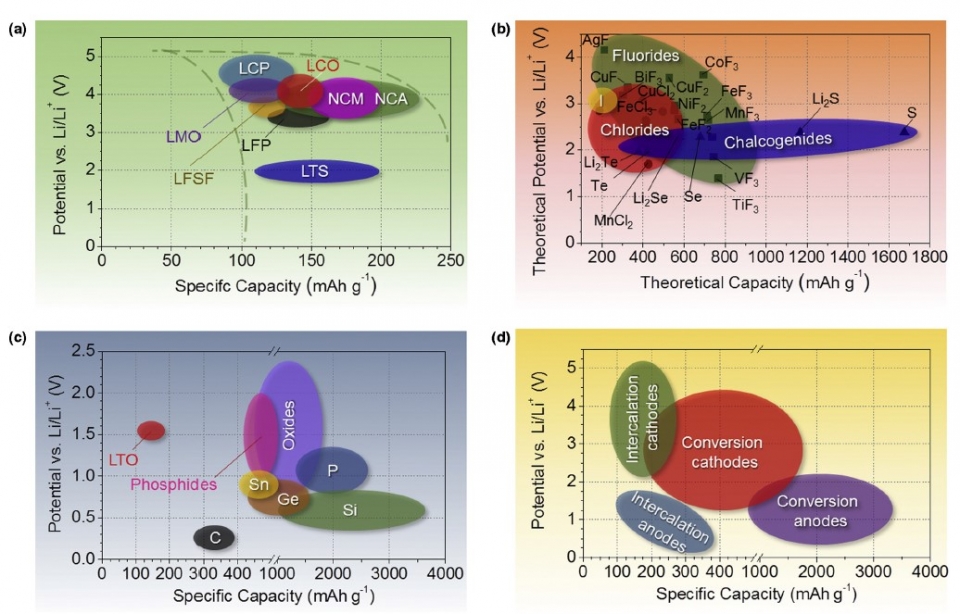
圖二 鋰離子電池常見之正負極材料電位與電容量關係圖。4
嵌入式正極之物理機制以固態物理中之「嵌入過程」作解釋。鋰離子為客體離子嵌入於適合尺寸之主體晶格中,並於反應時進行嵌入與嵌出且不改變晶體本身結構。具此特質者,可作為優秀之嵌入式正極。因過程中不改變晶體本身結構,故其循環效率佳,且體積變化率小。
嵌入式正極可分為層狀式結構、尖晶石結構、橄欖石結構等材料,鈷酸鋰極為層狀式結構之最佳例。尖晶石結構則由Thackery等人5於1983年將錳酸鋰(LiMn2O4; LMO)應用於鋰離子電池中期望取代鈷酸鋰。雖然其毒性與成本低,然電容量僅約100至120 mAh g-1,實際應用上表現較差。橄欖石結構於Padhi等人6於1997年以磷酸鐵鋰(LiFePO4; LFP)應用於正極材料,此材料能量密度約170 mAh g-1且熱穩定性與功率密度高,工作電壓為3.4V之高水準,亦為科學家與業界重視之材料。上述材料之結構與放電曲線如圖三所示,圖三為鈷酸鋰(LCO)、錳酸鋰(LMO)、磷酸鐵鋰(LFP)、LiFeSO4F(LFSF)等結構,多數研究皆以過渡金屬氧化物與聚陰離子化合物為主。
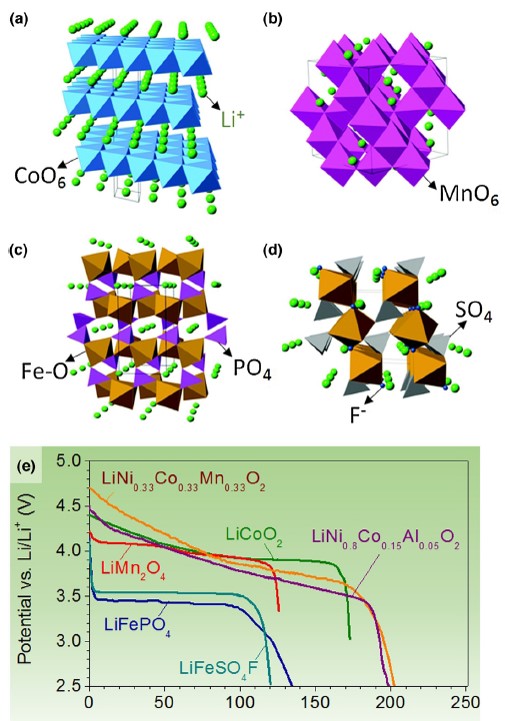
圖三 鋰離子電池嵌入式正極材料結構與放電曲線圖。4
反應式正極則以化學反應為儲能方式,此將改變晶體結構,反應式正極之反應式為下
第一型:MXz + yLi ↔ M + zLi(y/z)X
第二型:yLi + X ↔ LiyX
第一型以高價金屬離子(2價或以上)與鹵素為主之金屬鹵化物,其高價離子可得高理論電容量;第二型為硫、硒、碲與碘,其中硫之電容量最高且地球含量豐富故成本較低,為此反應式正極材料最廣應用,然其與水氣易形成硫化氫之缺點仍無法改善。
負極以鋰金屬、石墨、鈦酸鋰、矽等材料為主,最先發展鋰離子電池即以鋰金屬為負極,因鋰金屬具相當高之電容量(約3840 mAh g-1)、重量輕、能量密度與功率密度高之優點,最大問題仍為安全性疑慮。故石墨雖電容量不高(約372 mAh g-1),其高安全性與低成本為研發商用鋰離子電池之首要目標,故現今商業鋰離子電池多以石墨材料為主要應用。矽之電容量相當高(約3579 mAh g-1),然其充電後之體積變化劇烈,易使其於電流收集器上剝落,故整體循環效率差。鈦酸鋰(Li4Ti5O12; LTO)之穩定度高,且可承受高電流之循環,缺點為電容量低(僅175 mAh g-1),故其應用上常以複合式電極之方式結合鈦酸鋰使其提高電容量。
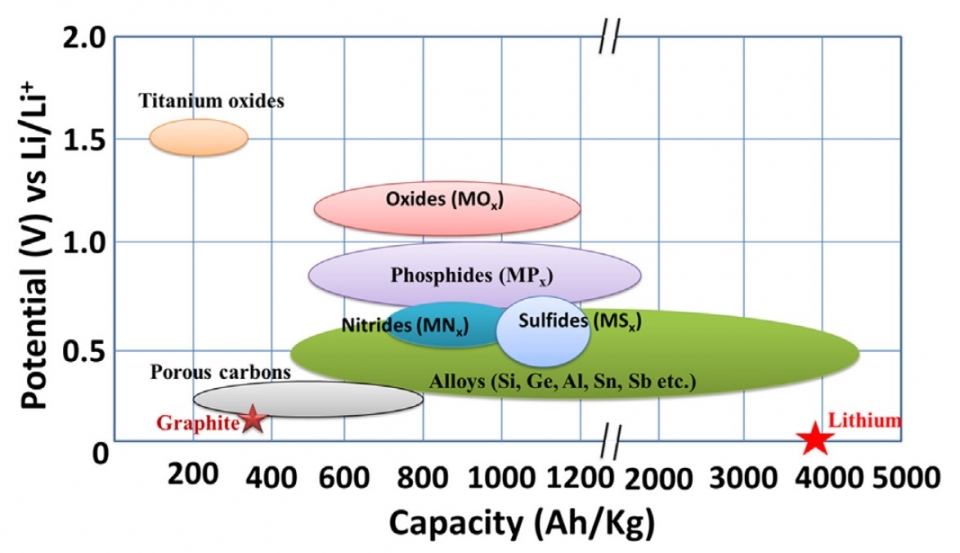
圖四 負極材料電壓與電容量比較圖。7
電解質為鋰離子電池之核心,為使鋰離子僅於電池內部移動且電子僅於外部電路移動,電解質需具備高鋰離子導電度與低電子導電度之特性。現今商用鋰離子電池仍為液態電解質與膠態電解質為主,其以鋰鹽結合有機溶劑或高分子材料為應用。有機溶劑需為非水系材料,因鋰金屬與水將反應產生氫氣故易爆炸,常用有機溶劑為乙醚(ether)、乙烯碳酸酯(ethylene carbonate)等。高分子材料開發則為解決有機溶劑於高溫易燃且易爆,常用高分子為聚乙二醇(poly(ethylene oxide); PEO)、聚丙烯腈(poly(acrylonitrile); PAN)等,鋰鹽則如圖五所示各式鋰鹽之比較,各式鋰鹽皆具其優點與缺點,現今常用鋰鹽為雙三氟甲烷磺酰亞胺鋰[lithium Bis(trifluoromethanesulfonyl); LITFSI]與六氟磷鋰(LiPF6)為主,六氟磷鋰優點為整體電化學穩定度高,然其熱穩定度低。故科學家以LITFSI取代六氟磷鋰為近期應用,然此鋰鹽鋰離子導電度低且易腐蝕鋁電流收集器。
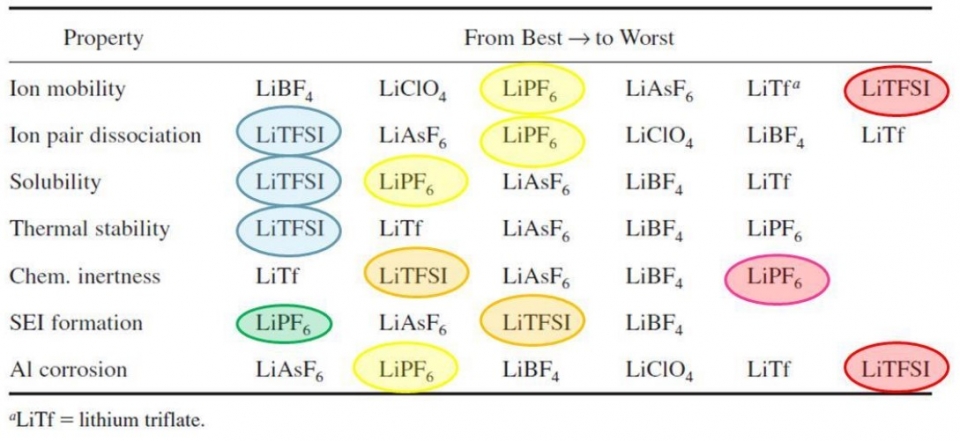
圖五 各式鋰鹽特性之比較圖。(圖片來源 : ELIBAMA)
諾貝爾化學獎及得主
108年度之若貝爾化學獎授予古迪納夫(John B. Goodenough),惠廷翰(M. Stanley Whittingham)與吉野彰(Akira Yoshino)三位科學家以表彰他們對鋰離子電池發展之突出貢獻。
第一代鋰離子電池之發明者惠廷翰出生於英國,先後於牛津大學取得學士,碩士與博士學位。此後惠廷翰旅居美國,開始於史丹佛大學進行博士後研究,後又成為埃克森公司(Exxon)之研發人員。上世紀七十年代,科學家希望以鋰離子電池替代石油以應對當時之石油危機。惠廷翰當時為埃克森公司(Exxon)之研發人員,埃克森公司乃一間經營石油相關業務之公司,為應對石油危機此公司開始研究替代石油之鋰離子電池。惠廷翰受埃克森公司之支持開展鋰離子電池之研究,並以二硫化鈦為正極,鋰金屬為負極製成第一代鋰離子電池,為鋰離子電池研究之先驅。2第一代鋰離子電池中鋰金屬負極之枝晶導致電池短路。故改用鋰鋁合金替代鋰金屬以抑制枝晶之形成。此一電池由埃克森公司商業化用於電子手錶。由於其低能量密度(130 Wh Kg-1)且硫化物正極分解產生刺激性硫化氫氣體,未實現大規模商業化。

圖六 108年度諾貝爾化學獎得主照片,自左至右依次為古德納夫、吉野彰與惠廷翰。(圖片來源 : The Wall Street Journal)
古德納夫乃出生於德國之美國人,其父兄皆為大學教授。古德納夫幼時患閱讀障礙症,後考入耶魯大學數學系。二戰爆發,古德納夫奔赴反法西斯戰場服役。戰後古德納夫回到實驗室,於芝加哥大學進行固態物理之研究並獲博士學位,此後於麻省理工學院工作多年。七十年代,古德納夫執教於英國牛津大學,此事石油危機爆發,尋找替代石油之動力來源成為研究熱點。惠廷翰業已研製出第一代鋰離子電池。為進一步提高鋰離子電池之容量,時任牛津大學教授之古德納夫開發以層狀過渡金屬氧化物為正極材料之鋰離子電池,鈷酸鋰正極材料就此問世。此一正極材料具高工作電壓與結構穩定之優勢。3鈷酸鋰正極材料之開發為鋰離子電池之大規模商業化奠定基礎。,此一研究成果使得古德納夫於九十七歲高齡獲得諾貝爾化學獎,成為諾貝爾獎之年齡最高獲得者。
吉野彰出生於日本,幼時仰慕諾獎得主福井謙一,後考入京都大學工學部石油化學科,於福井謙一之指導下完成學士與碩士學位。此後吉野彰任職於旭化成株式會社,透過向鋰離子電池引入“搖椅效應”。吉野彰以石墨替代鋰金屬負極,將負極從儲存鋰金屬變為儲存鋰離子,實現對枝晶之有效抑制。配合高電位之鈷酸鋰正極材料,新型鈷酸鋰加石墨鋰離子電池問世。此一電池於上世紀九十年代由索尼公司實現商業化,應用於電子產品之電能供應,成為首款實現大規模商業化之鋰離子電池。然而其於此時尚未獲得博士學位,2005年時吉野彰方才自大阪大學獲得博士學位。從吉野彰之經歷可見重要研究成果並非只有博士才可完成。
三位獲得諾貝爾化學獎之前輩科學家中惠廷翰與吉野彰當時皆為公司之研發人員,而古德納夫為大學之教授。可見改變人類生活方式之科學發明需由學界與產業界之通力合作方可成功。
鋰離子電池應用
現今鋰離子電池以3C產品為主要應用,然小體積之3C產品已無法滿足現代人對鋰離子電池之寄望。為解決溫室效應等環境破壞,不僅需降低火力發電源,更需降低汽車燃油之廢氣排放,且鉛蓄電池之能量密度遠低於鋰離子電池,故現今電動車研發以鋰離子電池為主,電動車又分為油電混合與純電動車,現今大多仍以油電混合車為主,純電動車意即其需大量電池動力來源,且需充電時間短亦可長距離移動。傳統鋰離子電池以逐漸無法負荷以上需求,未來全固態式鋰離子電池將可完成純電動車之要求。
鋰離子電池未來之發展
經四十餘年之發展,鋰離子電池之能量密度業已提升至260 Wh Kg-1,并廣泛應用與電動汽車、移動電子設備以及電能儲存。當前,進一步提升能量密度與安全性乃鋰離子電池未來發展之方向。鋰金屬負極具有高容量(3860 mAh g-1)與低氧化還原电位(-3.045 V)之優勢,乃替代碳基與矽基負極之候選材料。但鋰金屬之低氧化還原電位亦使其具高化學活性,易與電解液發生化學與電化學反應。此外,充放電過程中鋰離子之非均勻性沉積與脫出致使鋰金屬負極表面出現枝晶。枝晶若刺破隔離膜則導致鋰離子電池短路,可造成電池之熱失效與起火等安全危害。
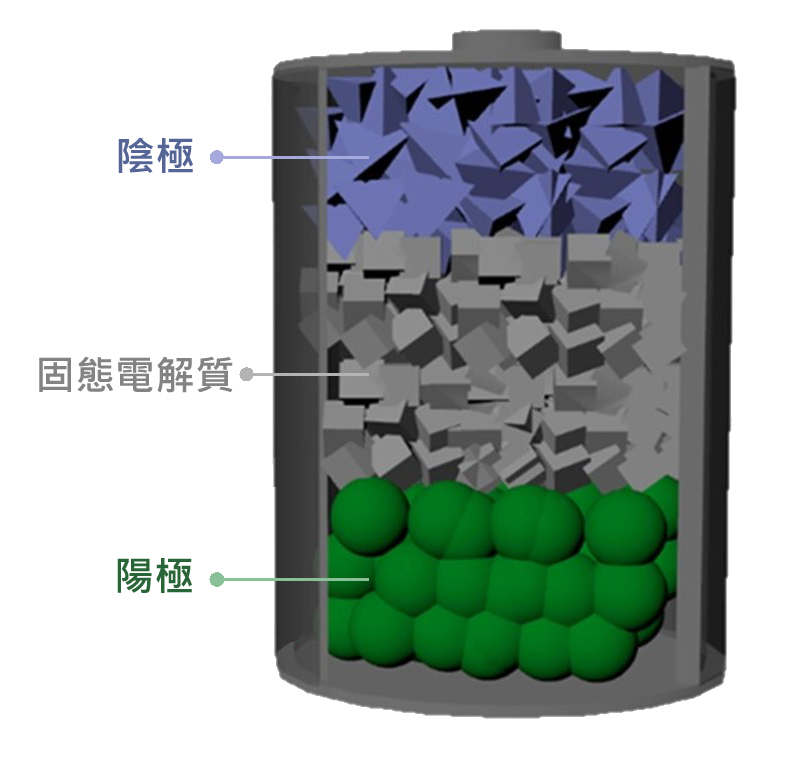
圖七 全固態電池結構圖。
以無機固態電解質代替可燃性有機液態電解液乃抑制枝晶生長與安全危害之有效方法。固態電解質之早期研究認為固態電解質可完全消除枝晶與界面副反應。然而,近期多項研究成果表明枝晶與界面副反應依然存在於全固態電池。但無機固態電解質之非可燃性使得全固態電池之安全性較傳統電池大為提高。無機固態電解質雖具高安全性之優勢,但無機固態電解質之陶瓷片製造過程複雜,大面積之陶瓷片製備難度高,導致無機固態電解質難以實現工業化生產。聚合物與無機固態電解質顆粒製成之復合膜具有製程簡單、低成本之優勢,成為產業界替代無機固態電解質陶瓷片之不二選擇。此類複合膜材料具高柔韌度之特徵,若配合柔性屏幕可製成穿戴式電子產品,具廣闊之發展空間。聚合物之穩定性隨不如無機材料,但其耐熱性仍高於有機電解液。故此,聚合物與無機固態電解質構成之複合膜為當下產業界與學界合理開發之重點。
當前,全固態電池仍屬於研究階段,尚未投入大規模生產。工業技術研究院、國立台灣大學、國立成功大學、國立台灣科技大學等機構為國內固態電池研究之先驅,為產業發展奠定良好之基礎。輝能、豐田、寧德時代等公司亦已投入固態電池之開發。輝能、清陶、浙江鋒鋰、衛藍科技等公司已投入少量固態電池之生產,但全固態鋰離子電池並未大規模占領市場。固態電池之發展具廣闊之空間,將成為未來二十年鋰離子電池發展之新方向。
結論
古迪納夫,惠廷翰與吉野彰三位致力於研究鋰離子電池之科學家獲得108年度之諾貝爾化學獎乃科學界對其研究成果之肯定,亦為對鋰離子電池發展注入一針強心劑,同時亦說明鋰離子電池業已趨於成熟。古迪納夫教授表示,願意再工作五年以實現鋰離子電池之固態化。可見全固態電池將成為鋰離子電池未來之發展方向。由於環境與能源制約人類社會之可持續發展,鋰離子電池必將取代化石能源成為人類之主要消費能源。全固態鋰離子電池亦必將成為市場消費之主要電池類型。
參考資料
[1] A. Manthiram, J. Kim, Chem. Mater. 10, 2895 (1998).
[2] M. S. Whittingham, Science 192, 1126 (1976).
[3] K. Mizushima, P. Jones, P. Wiseman, J. B. Goodenough, Mater. Res. Bull. 15, 783 (1980).
[4] N. Nitta, F. Wu, J. T. Lee, G. Yushin, Mater. today 18, 252 (2015).
[5] M. Thackeray, W. David, P. Bruce, J. B. Goodenough, Mater. Res. Bull. 18, 461 (1983).
[6] A. K. Padhi, K. S. Nanjundaswamy, J. B. Goodenough, J. Electrochem. Soc. 144, 1188 (1997).
[7] S. Goriparti, E. Miele, F. D. Angelis, E. D. Fabrizio, R. P. Zaccaria, C. Capiglia, J. Power Sources 257, 421 (2014).
本文作者:劉如熹 國立台灣大學化學系
仝梓正 國立台灣大學化學系
廖譽凱 國立台灣師範大學物理系
胡淑芬 國立台灣師範大學物理系