以光窺腦-利用光學顯微鏡觀察大腦
- 物理專文
- 撰文者:林彥穎,秦安侖(國立清華大學腦科學研究中心)
- 發文日期:2018-03-23
- 點閱次數:1475
前言
好奇心驅使人類不停地探索未知的知識,大至浩瀚無涯的宇宙,小至各種基本粒子,都充滿了迷人的魅力。以歷史記載來看,從中國的哲學家莊子 ( 西元前 369-286 年 ) 提出的濠梁之辯「子非魚安知魚之樂」,到西方哲學家笛卡爾 (René Descartes, 1596-1650) 提出「我思故我在」這些哲學論述,就知道理解大腦是大多數人都感興趣的方向。所以古代的哲學家們,即便沒有適合的工具及方法,也不停地透過各種哲學論述來探索大腦。
物理學的發展,實現了許多掃描人類大腦活動的工具,例如磁振造影 (MRI, magnetic resonance imaging)、功能性磁振造影 (fMRI, functional magnetic resonance imaging)、X-ray 電腦斷層掃描 (X-ray CT, Computed Tomography)、正子斷層掃瞄 (PET, positron emission topography)、腦電波掃描 (EEG, electroencephalography) 及腦磁波掃描 (MEG, magnetoencephalography) 等,透過這些大腦掃描技術,人類對於大腦的工作機制的認識越來越豐富,似乎只要只缺臨門一腳,就可以對大腦有完整的了解。因此 2013 年美國總統歐巴馬宣示推動為期十二年的「腦啟動計畫」(BRAIN Initiative, Brain Research through Advancing Innovative Neurotechnologies),預計投入 45 億美元的研究經費,號召政府及民間合作,發展新一代腦科學技術來探索腦的祕密。歐盟也在瑞士的洛桑聯邦理工學院主導下,推出了「Human Brain Project」(HBP),建立人腦的連結體模型並進行大規模的電腦模擬。繼美國、歐盟之後,日本、中國等國家相繼宣布國家級的腦科學計畫,儼然形成一個國際上各國競逐的腦科學嘉年華。本文將介紹臺灣科學家們透過物理學、工程學及神經科學等合作跨領域創新對這場腦科學嘉年華帶來的貢獻。
人腦是終極目標
隨著醫學的進步,全球人口的平均壽命已經大幅的增加,但是人類隨著年齡的漸增,身上的的神經網路也跟著老化,根據統計有近半數 85 歲以上的成年人患有阿茲海默症 (Alzheimer’s disease),約有 5–10% 年齡在 65 歲上的人,開始受到阿茲海默症的困擾,已成為老年健康的最大威脅之一。同時人口的密度越來越高,人與人之間相處競爭的壓力也隨之增加,所以青壯年人口精神方面的疾病,也是一種困擾許多人的文明病。始於幼兒少年時期的注意力不足過動症 (ADHD, Attention Deficit Hyperactivity Disorder) 及自閉症光譜障礙 (ASD, Autism Spectrum Disorder),更是讓許多家庭感到困擾。因此國際上持續對於腦科學的支持,希望透過對於大腦運作的機制能夠有更全面性的了解,在有朝一日提供更有效的治療方針,所以各國腦科學研究,都是以理解人類的大腦為終極目標。
極廣又極細緻的挑戰
神經細胞的細胞本體 (soma) 約有數微米大,但是神經細胞的軸突 (axon) 及樹突 (dendrite) 的分布卻有可能廣及動物全身,而神經元之間的突觸 (synapse) 間隙卻只有數十奈米。這樣的特徵讓研究大腦這項工作充滿了挑戰,利用金屬染色技術,我們可以在電子顯微鏡下把大腦組織裡的單一突觸特徵完整紀錄下來,但是假如想要以電子顯微鏡把大腦內的每個突觸與神經型態都完整記錄下來,極為曠日廢時。而另外一端是利用各種臨床上的工具,例如:磁振造影、X-ray 電腦斷層掃描等,可以獲得完整的人類大腦影像,但是
受限於解析度與對比,無法了解到神經細胞間交互作用的細節。因此自從 19 世紀末卡哈把構成大腦的細胞命名成神經之後,整個二十世紀人類透過各種工具及方法把單一神經元或少數神經元的特性都逐一的了解清楚了,但是目前還是不能回答「人為甚麼會思考、記憶及學習 ?」這個哲學性的問題,因此在科學雜誌第 125 周年的慶祝特刊中,把「意識的生物學基礎是什麼?」(What is the biological basis of consciousness?)1 列為第二大具有大衝擊及艱難挑戰的研究課題。
人腦有 860 億個神經細胞分布在約 1300 立方公分的空間中,不論在神經數量及體積上都不是目前觀測技術可以直接解答的,所以各種不同的模式動物便是研究人腦前的重要試金石。而諸多不同的觀測方法各有不同的優勢,雖然光學系統從解析度及可以觀測的範圍都沒辦法取得絕對的優勢,但是由於儀器建構上的費用上較為經濟也比較容易與其他的方法整合,所以還是腦科學研究上最廣為被採用的工具之一。特別是隨著創新概念的發展,人們發展了許多可以解析超越光學繞射極限的架構,如圖一、為台大物理系的朱士維教授、清大腦科學中心研究人員與筆者跨領域、跨校共同發展的多光子超顯微成像技術 2。
此種技術使用多光子超取樣及計算的方式達成三維超解析影像,是少數有潛力可以跟活體功能性影像結合的方法。
| (a) | (b) |
 |  |
圖一、(a) 是雙光子影像取像的結果,(b) 是台灣發展的3維多光子超顯微成像技術,可以將解析度提升1.8倍。
國際上發展概況
神經網路的基本構造為「連結體」(connectomics),由數量龐大的神經元為單位構成,而這些神經細胞使用來溝通的主要「語言」便是透過突觸傳遞給彼此的化學訊號,而每一個神經元又利用是利用改變神經細胞上細胞膜電位的電訊號,來將一處透過神經傳導物質得知的訊息,迅速傳遞到或近或遠的大腦別處加以分析處理。因此傳統上除了特別觀察突觸構造的電子顯微鏡外,了解神經網路的基本構造的方式,便是利用各種染色方式,配合各種包埋切片的方法解構三維的神經網路,大範圍地觀察神經元的型態與走向,但是此種方式在刀片切削面的組織型狀難免被擠壓破壞,因此在共軛焦顯微鏡設備被商品化之後,以針孔過濾焦平面資訊結合雷射激發光源來掃描取像的虛擬切片的方式,成為主流的三維生物組織重組觀察的方式。而觀測神經細胞溝通語言的傳統方式,便是利用電極探針,插入想要觀察的區域,直接監測細胞膜上電生理的變化,此種方式雖然空間解析度不佳,但是在時間解析度及電壓敏感度上有空前的突破 3,更值得注意的是隨著各種電子儀器飛快的進步,讓此種方法已經可以在微秒 (μs) 範圍內偵測到單一離子通道的開關 4,然而接觸式的電極除了空間解析度低之外,對於觀察的目標還是會造成一定程度的破壞,因此當最近幾年來利用基因工程組合成的光敏離子通道、電壓敏感螢光蛋白及鈣離子濃度監測蛋白的技術成熟,利用光這種非侵入式技術來觀測及操弄神經細胞間的交互作用。變成一個引人矚目的方向 5如同傳統電生理實驗隨著各種儀器設備的進步,不斷的將觀測極限推到驚人的地步,利用光來進行神經科學研究也會不斷的因為科技的發明,走入更實用化的地步。
隨著各種跨領域合作的完成,的確讓光在神經科學研究上扮演更多的角色,舉例來說光敏離子通道 ChR2 (channelrhodopsin-2)6 及 NpHR(halorhodopsin) 7,實現了非破壞性神經網路操控技術。同樣的隨著共軛焦顯微術的進步及超快雷射的發展,促使 1990 年雙光子顯微術的發明 8 給了神經科學研究革命性的發展,借由進紅外光吸收及散射都比較少的狀況下,人們開始可以利用光來觀測活組織內的深處結構及活動,並且有三維次微米(sub-μm ) 的空間解析度。由於光學技術在神經科學的應用發展都十分蓬勃,所以將以大體積造影光學顯微術、功能性造影光學顯微術、光操弄神經網路行為觀測平台幾個分項來
討論目前世界在這些課題上的發展。
大體積造影光學顯微術
雖然雷射掃描共軛焦顯微鏡可以提供虛擬切片的能力,而且應用雙光子激發的技術也證明了可以觀察深度高達 1000 微米的組織影像 9,但是這些研發成果仍然是不足以來觀察哺乳類動物的腦神經網路,所以採用切片方式配合各式顯微術仍然是很重要的發展方向。舉例來說 2010 年科學雜誌刊出了利用樹脂包埋及高基氏染色的方式,來呈現小鼠腦的神經連結的成果 10,雖然這個作法早在 2008 年就由 Texas A&M University 的研究人員實現過 11,但是由於 A. Li et al. 所呈現高品質腦神經網路連結對於神經科學的研究十分重要,只要小心的調整各種技術上的細節,成果仍然令人重視。另外一個佐證是,2012 年的 Kavli Prize頒給 Prof. W. Denk,表彰其在 2004 年結合切片技術及電子顯微鏡所建立的 serial block-
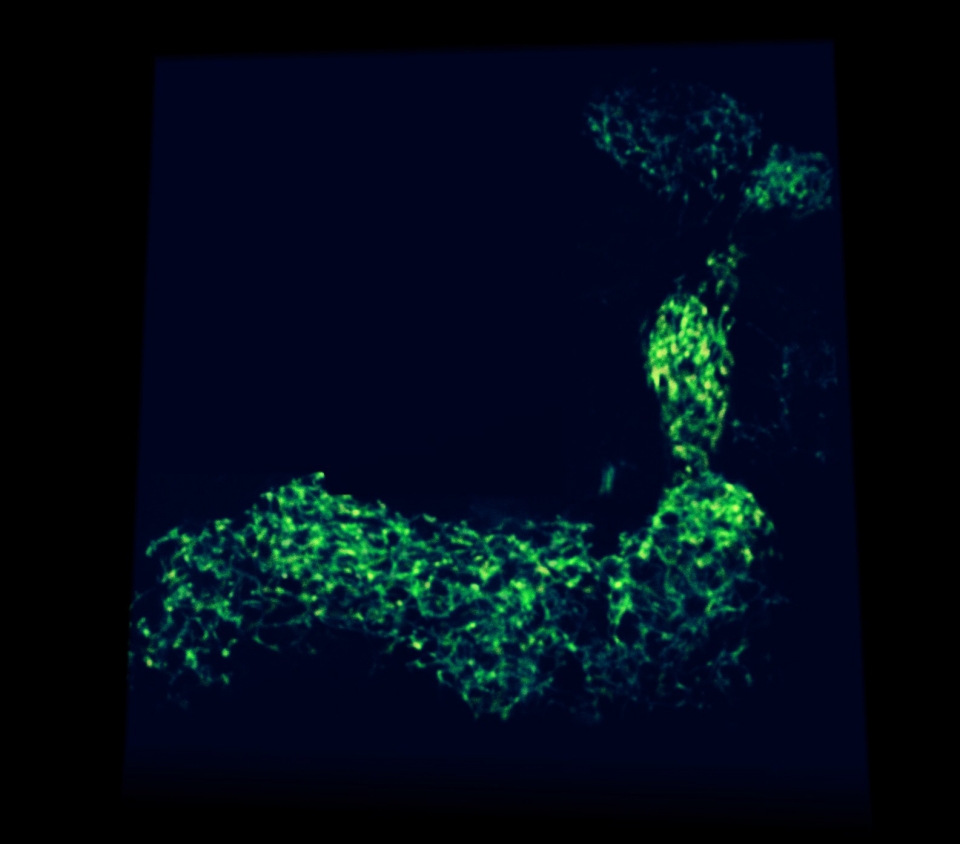
face electron microscopy (SBEM)12,因此如何使得各式顯微技術擴大可觀測的範圍,的確是一個重要的方向。但是至今這些這些作法都還是會遭遇到切片處樣品變型的問題,所以有人提出結合雙光子顯微術及切片技術可以解決此問題 13。而台灣研究人員透過清華大學江安世所發明的 FocusClearTM 組織澄清技術及雷射掃描共軛焦顯微術,進行果蠅腦神經網路的收集,因為果蠅腦中的單一神經約僅有十三萬顆,而且很多疾病、基因表現都與人腦很類似,所以台灣研究人員發表果蠅腦單一神經資料庫 14,15,也是第一個提供全球研究人員單一物種最多單一神經資料最多的資料。目前研究團隊更進一步的配合精密的自動化機械,來將果蠅腦單一神經的收集往果蠅全身的影像來堆疊,利用這個相對小的模式生物了解全身的神經網路與肌肉等其他組織如何協調運作 ( 圖二 ),會更全面的了解神經網路的運作。
圖二、[大體積顯微影像掃瞄系統]重建的果蠅前進步行神經全身網路圖,可以清楚見到激發後驅動果蠅前進步行的綠色神經網路,隱藏在藍色外殼內與紅色肌肉組織深處的分布情形。此一新開發的系統直接從單隻果蠅樣本中重建此一神經性統與全身組織的結構關係,省略了傳統研究方式的人工解剖與單一小區域大量累積資料分析的時間成本,並保留了同一樣品再進行單一特定區域高解析尺度的進一步分析的應用空間。本影像由腦科學中心陳俊彥博士後研究員完成,系統由腦科學中心林彥穎研究員指導林宇捷同學開發。
功能性造影光學顯微術
傳統電生理需要多個電極才能監控多個神經細胞的活動,相關實驗技術門檻很高,但是透過結合雙光子顯微術及鈣離子功能性造影顯微術,同時記錄多點的鈣離子濃度相較易於達成 16,17,由於利用鈣離子影像來成為大腦功能性造影顯微術監控的目標有許多優點,所以有許多的研究工作都如火如荼的進行 18,台灣的研究團隊也利用利用鈣離子功能性造影顯微術來研究果蠅的聽覺神經網路 19、及解密嗅覺傳遞線路的轉軌效應 20,雖然利用光學影像技術來監控神經細胞的活動有許多好處,但是還是有一些問題,例如:光漂白、光損傷等問題。因此要記錄更完整的「神經網路樂章」,需要使得時間解析度到達毫秒等級 21, 並且要直接記錄神經的動作電位,因此這個部分的技術挑戰有三個部分:1. 發展更高速的顯微掃描技術。2. 利用效率更高及更快的單一神經動態指標。3. 利用更長的激發波長及非線性光學顯微術來避免光漂白及光損傷的問題。
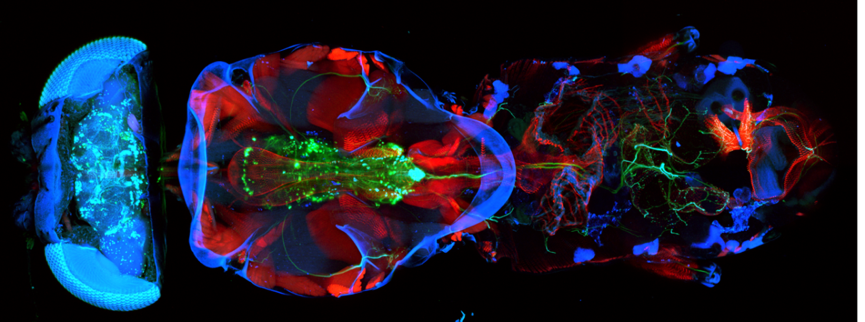
雙光子顯微術發明後 22,全球科學家利用各種非線性光學原理來成像,已經使得光學顯微鏡有了巨大的進步,我們把這些技術全都歸納成多光子顯微術,多光子顯微術有本質具有光學切片的能力、更深的組織穿透力,跟較少的光學毒性 (phototoxicity),已經成為神經科學研究一個不可或缺的工具 23,然而目前多光子顯微鏡的主要研究方向就是改進其受限的影像擷取速度。特別是在研究神經訊號傳導方面,已經有許多高速多光子顯微術的研究,例如:線掃描顯微術 24、多焦點多光子顯微術 (multifocal multiphoton microscopy, MMM)25,及隨機存取顯微術 (random access microscopy)26,前兩種方法透過改變焦點的形狀來增加掃描的速度,但是這就需要提高雷射的能量。而我們利用高速的焦點掃描技術掃過整個果蠅腦,因此現在觀測神經網路已經從單一光學切面到每次觀測一整個空間的時代 ( 圖三 )。
圖三、利用腦科學中心跨領域、跨校團隊發展的快速空間顯微影像系統,可以用極短的取像時間,迅速重建果蠅全腦中嗅覺訊號傳遞網路的立體資訊。途中用顏色代表訊號深度的深度編碼影像,貫穿整個果蠅腦兩百微米的組織深度,將把嗅覺訊號從果蠅大腦最前端的深藍色區域嗅小球往大腦後端紅色分析區域傳遞的神經叢立體型態描繪出來。此一系統搭配功能造影影像技術,將取代傳統共軛焦顯微鏡單一焦平面掃描的限制,達成微米尺度高解析度的神經系統直接紀錄立體功能造影。
光操弄神經網路行為觀測平台
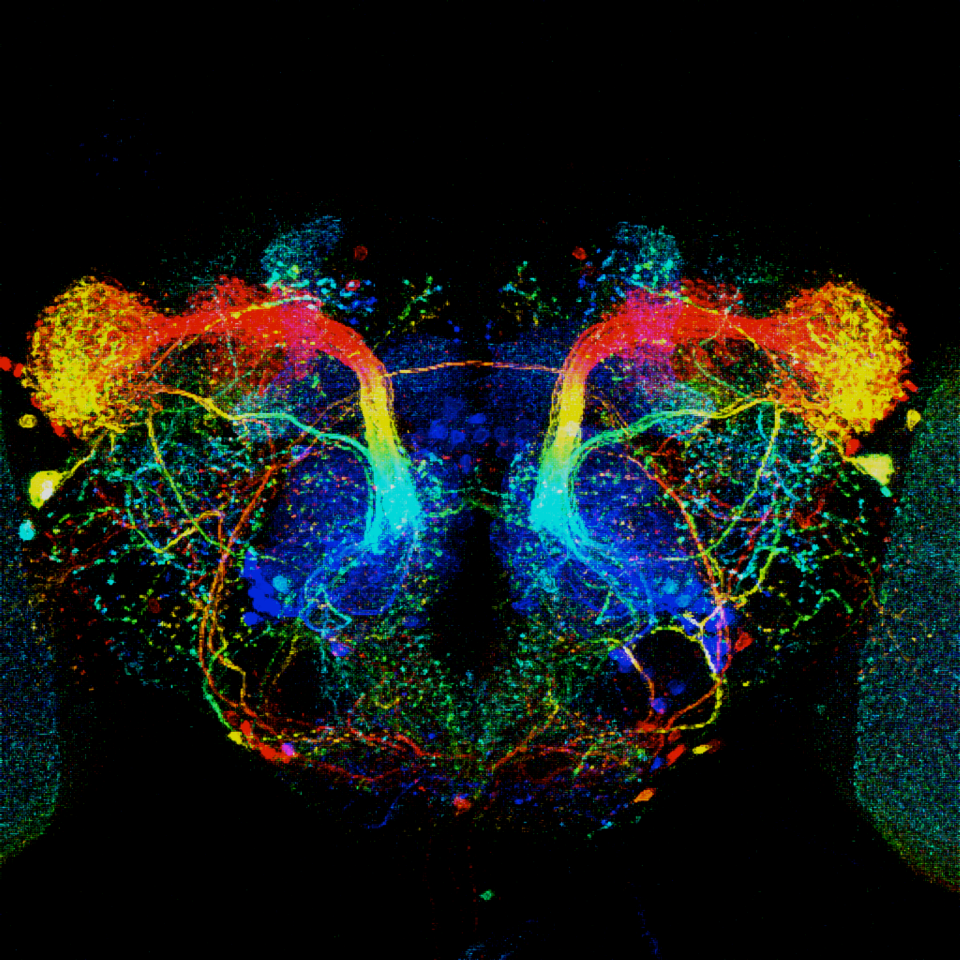
人或動物行為的研究,是一種把科學研究跟普羅大眾的生活連結起來最直接的方式。像巴甫洛夫 (Ivan Petrovich Pavlov, 1849-1936) 的古典制約的狗搖鈴鐺實驗,至今還是為人津津樂道。隨著光光敏離子通道的發明,對於果蠅行為的研究就有了更大的變革,因為除了利用傳統的電極、熱休克蛋白等工具之外,生物學家多了光這種工具來及時的針對特定的神經網路進行操控。所以目前來說結合基因工程,可以將光敏離子通道放在指定的神經網路上,然後再以光照射變可以興奮或抑制神經活動。再加上雷射具有高度的空間指向性,所以就有一些以刺激單一細胞為目的行為觀察平台出現 27,但是此種平台的缺點就是視野很小,所以比較不適合進行動物間社交行為的研究。利用雷射追蹤果蠅訓練機,進行具有空間解析度的果蠅行為訓練。透過光驅動離子通道來興奮神經及果蠅 T 通道 (T maze) 訓練機 28 已經可以設計許多新的行為實驗,但是進一步利用雷射具有良好的空間指向性, 便可以建構激發單一神經細胞的行為觀測平台 29。我們的目標在於進行果蠅社交行為的實驗,所以將設定空間解析度為 1 µm,觀測區域達 30 µm 的雷射追蹤果蠅行為訓練機,透過光來操作單一果蠅的神經網路,進行果蠅行為的研究 30( 圖三 )。

圖四、(a) 利用三色雷射追蹤果蠅行為訓練機,可以訓練公果蠅違反天性逃離接近的母果蠅。(b) 利用此一平台、大體積顯微影像掃瞄系統與果蠅大量的特定神經表達基因工具,清華大學腦科學中心已經建立一系列資料庫,記錄各種特定神經群型態與果蠅行為間的相互關係。(a) 楊美美小姐美編。系統由腦科學中心蕭伯彥博士與吳明親博士開發。
總結
全球公開的各種動物約3萬種腦神經細胞3D影像,其中約2/3由臺灣研究團隊所提供。整合包括物理學、生物科技、資訊工程、奈微機電、與光學顯微技術等領域的系統與人才,以持續推動建立高解析度模式生物腦神經網路3D影像資料庫。在明瞭大腦的基礎網路結構和運作原理,可以幫助理解人腦神經退化性疾病成因,進而提供診療及治療的新方向。也可以利用果蠅腦相對簡單的設計,發展更聰明的人機互動,甚至可以自我決定的人工智慧電腦。
[1] G. Miller, "What Is the Biological Basis of Consciousness?" Science 309, 79- (2005).
[2] I.C. Su, K.J. Hsu, P.T. Shen, Y.Y. Lin, and S.W. Chu, "3D resolution enhancement of deep-tissue imaging based on virtual spatial overlap modulation microscopy," Opt. Express 24, 16238-16246 (2016).
[3] A. L. Hodgkin, and A. F. Huxley, "Action potentials recorded from inside a nerve fibre," Nature 144, 710-711 (1939).
[4] O. P. Hamill et al., "Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches," Pflugers Archiv-European Journal of Physiology 391, 85-100 (1981).
[5] M. Scanziani, and M. Hausser, "Electrophysiology in the age of light," Nature 461, 930-939 (2009).
[6] E. S. Boyden et al., "Millisecond-timescale, genetically targeted optical control of neural activity," Nature Neuroscience 8, 1263-1268 (2005).
[7] B.Y. Chow et al., "High-performance genetically targetable optical neural silencing by light-driven proton pumps," Nature 463, 98–102 (2010).
[8] W. Denk et al., "Two-photon laser scanning fluorescence microscopy," Science 248, 73-76 (1990).
[9] P. Theer et al., "Two-photon imaging to a depth of 1000 mm in living brains by use of a Ti : Al2O3 regenerative amplifier," Opt. Lett. 28, 1022-1024 (2003).
[10] A. Li et al., "Micro-optical sectioning tomography to obtain a high-resolution atlas of the mouse brain," Science 330, 1404-1408 (2010).
[11] D. Mayerich et al., "Knife-edge scanning microscopy for imaging and reconstruction of three-dimensional anatomical structures of the mouse brain," Journal of Microscopy 231 134–143 (2008).
[12] W. Denk, and H. Horstmann, "Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure," PLoS Biology 2(11), e329 (2004).
[13] T. Ragan et al., "Serial two-photon tomography for automated ex vivo mouse brain imaging," Nature Methods 9, 255-258 (2012).
[14] Chiang AS*, Lin CY, Chuang CC, Chang HM, Hsieh CH, Yeh CW, Shih CT, Wu JJ, Wang GT, Chen YC, Wu CC, Chen GY, Ching YT, Lee PC, Lin CY, Lin HH, Wu CC, Hsu HW, Huang YA, Chen JY, Chiang HJ, Lu CF, Ni RF, Yeh CY, and Hwang JK, "Three-dimensional reconstruction of brainwide wiring networks in Drosophila at single cell resolution," Current Biology 21, 1-11 (2011).
[16] K. Ohki et al., "Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex," Nature 433, 597-603 (2005).
[17] K. Sohya et al., "GABAergic neurons are less selective to stimulus orientation than excitatory neurons in layer II/III of visual cortex, as revealed by in vivo functional Ca2+ imaging in transgenic mice," J. Neurosci. 27, 2145-2149 (2007).
[18] C. Grienberger, and A. Konnerth, "Imaging Calcium in Neurons," Neuron 73, 862-885 (2012).
[19] J. S.Y. Lai et al. , "An auditory circuit in the Drosophila brain," Proceedings of the National Academy of Sciences of the United States of America 109, 2607-2612 (2011).
[20] Lin HH, Chu LA, Fu TF, Dickson BJ, Chiang AS*, "Parallel neural pathways mediate CO2 avoidance responses in Drosophila," Science 340, 1338-1341(2013).
[21] B. F. Grewe et al., "High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision," Nature Methods 7, 399-450, (2010).
[22] Denk, W., Strickler, J.H. and Webb, W.W. ,"Two-photon laser scanning fluorescence microscopy," Science 248, 73–76 (1990).
[23] N. Ji et al., "Advances in the speed and resolution of light microscopy," Current Opinion in Neurobiology 18, 605-616 (2008).
[24] G. J. Brakenhoff et al., "Real-time two-photon confocal microscopy using a femtosecond, amplified Ti:sapphire system," J. Microsc.-Oxf. 181, 253-259 (1996).
[25] J. Bewersdorf et al., "Multifocal multiphoton microscopy," Opt. Lett. 23, 655-657 (1998).
[26] G. D. Reddy et al., "Three-dimensional random access multiphoton microscopy for functional imaging of neuronal activity," Nature Neuroscience 11, 713-720 (2008).
[27] Zhu, P. et al., " High-resolution optical control of spatiotemporal neuronal activity patterns in zebrafish using a digital micromirror device, " Nat. Protoc. 7, 1410-1425 (2012).
[28] G.S. Suh et al., "Light activation of an innate olfactory avoidance response in Drosophila", Current Biology 17, 905-908 (2007).
[29] A.M. Leifer et al., "Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans," Nature Methods 8, 147-152 (2011).
[30] Wu MC, Chu LA, Hsiao PY, Lin YY, Chi CC, Liu TH, Fu CC*, Chiang AS*, "Optogenetic control of selective neural activity in multiple freely moving Drosophila adults," Proceedings of the National Academy of Sciences of the United States of America 111, 5367-5372 (2014).