
疫情背後的數學
- Physics Today 專文
- 撰文者:Alison Hill (徐麗婷 譯)
- 發文日期:2021-05-15
- 點閱次數:3497
幾個簡單的數值就可以作為像COVID- 19這種疫情爆發的指標,但是要正確的計算出這些數值卻是出奇的棘手。
2020年可說是COVID- 19 大流行的一年:引發這個大流行的新冠病毒已經感染了數百萬人,並且超過一百萬人因此而死亡。就像愛滋病毒、茲卡病毒、伊波拉病毒、和許多流感毒株一樣,新冠病毒在大肆破壞之前,就已經從動物演化到人類身上。而我們與它的戰爭正在持續進行著。
當一種疾病爆發時(通常指的是具有某些相似病徵的病患人數出現異常峰值),科學家會地想了解新疾病。 是哪種微生物引起的感染? 它從哪裡來的? 感染如何傳播? 有什麼症狀? 哪些藥物可以治療呢? 而在當前的這個疾病大流行裡,科學正以熱切的步伐前進。 病毒基因組正快速地被定序和分析,我們可以看到受感染者和死亡人數的每日更新,而且每天都有數百篇待審的論文發表。
當一種疾病爆發時(通常指的是具有某些相似病徵的病患人數出現異常峰值),科學家會地想了解新疾病。 是哪種微生物引起的感染? 它從哪裡來的? 感染如何傳播? 有什麼症狀? 哪些藥物可以治療呢? 而在當前的這個疾病大流行裡,科學正以熱切的步伐前進。 病毒基因組正快速地被定序和分析,我們可以看到受感染者和死亡人數的每日更新,而且每天都有數百篇待審的論文發表。
有些科學家急切地穿上他們的實驗衣,以顯微鏡去研究新的傳染病;有些科學家則是奔向他們的計算機和程式碼。有幾個數值可以用來作為疫情爆發的指標,或用以指導公共衛生對策,並且提供複雜的模型來預測未來疫情的發展。 傳染病流行病學家、數學生物學家、生物統計學家和其他具有相關專業知識的人,都在試圖回答這幾個問題:感染傳播的速度有多快? 必須阻絕哪些傳染途徑來控制病毒散播? 感染者的傳染力會持續多長時間? 感染者需要住院或者死亡的機率有多大?
物理學常被認為是最需要數學的科學,但是理論和嚴格的數學分析也同樣是生態學、演化生物學、和流行病學的基礎1。科學家們帶著各種想法,在物理學與上述那些領域之間不斷地交流著 。 事實上,用數學來了解傳染病傳播的想法,比病菌致病論本身還古老。 流體力學家Daniel Bernoulli在1760 年就設計了一個模型來預測接種天花疫苗的益處2。諾貝爾獎得主Ronald Ross則是建立數學模型,鼓勵以控制蚊蟲數量來降低瘧疾傳播3。一些當今最多產的傳染病建模專家,最初都是接受物理學家養成的訓練。包括倫敦帝國學院的Neil Ferguson(他是英國政府對COVID-19 的政策諮詢師),還有巴黎索邦大學的Vittoria Colizza(他目前是疾病傳播網絡建模團隊的領導者)。
本文將會介紹用來表徵疫情爆發的數學量值、概述科學家如何計算這些數值、並且說明這些數值間差異所代表的意義。 就以COVID-19來說,每天都有關於這些數值的分享、辯論、和最新訊息。 物理學家習慣將現實世界的複雜現象精簡成有意義的、簡單的模型,並且聯合起來向公眾溝通傳遞他們的想法。
傳播動態
很少科學領域會有個單一指標參數如同傳染病流行病學的基本再生數R0 (basicreproductive number) 一樣,同時受到領域內外人士的大量關注。這個無單位數值指的是一個典型的感染者在易感染的族群中,可能平均會傳染給多少人 (即續發性感染 secondary infections)。這個數值可以用來描述某個疾病的傳染力高低、和評估疾病控制的難易度。(更多有關用模型來計算R0的資訊,請參見box 1。)
傳染病動態的研究中顯示,在臨界狀態或是某些行為門檻下,傳染病才會開始傳染。就像核鏈反應一樣,如果沒有達到某些條件,疫情就不會爆發。 R0值可以決定將會發生什麼結果。 如果疾病傳播是以連續微分方程來建模,那麼R0值可以決定何時會出現穩定或不穩定的平衡狀態。如果疾病的傳播是以一連串隨機的反應來建模,那麼R0值會關係著疾病未來比較可能會消失或是繼續發展。
大致上來說,R0取決於三個因素:(1)接觸率,就是感染者每天接觸的人數;(2)傳染力,就是在單位時間內與給定的感染者接觸而受到傳染的機率;(3)感染持續的時間。大多數傳染病控制的工作目標,就是藉由改變上述的一個或多個因素來降低R0值。例如, 可以藉由限制大眾的社交距離或針對個案作隔離,來降低與感染者的接觸率。再者可以通過戴口罩等措施,來減少與感染者互動中受到感染的機會,進而降低傳染力。 (有關更多呼吸道感染傳播的物理學相關資訊,請參見Stephane Poulain和Lydia Bourouiba 所寫的 ”Quick Study”,Physics Today, May 2019, p.70)。而感染持續的時間通常可以經由微生物清除療法來減少,例如用抗生素治療咽喉炎。但是目前還沒有適用於COVID-19的這類藥物。
然而,最終還有一種可以用來降低R0的方法,就是使用疫苗來減少受感染的個案數量。
作為一個指標, R0有若干個重大的限制。首先,它不會告訴我們這個疾病有多致命。例如有些感染的R0值較小,卻可能非常致命,像是SARS(嚴重急性呼吸道症候群);有些感染的R0值較大, 卻很少導致死亡,例如水痘; 另外還有一些感染,同時具有很高的R0值和很高的死亡風險,例如天花。 再者,R0並不能反映出疾病傳播的時間尺度。有些R0所描述的新病例平均數量可能是在幾天之內發生的,就像普通感冒一樣。但也有像典型的愛滋病毒這種會持續很多年的疾病。
與一般大眾認知相反,R0並不像用來表徵流體特性的雷諾數(Reynolds number),它無法反映出感染的原始特性。R0的量測有很大部分取決於疾病的傳播環境。 同樣的傳染病,若發生在人口擁擠、衛生條件差、和因營養不良造成免疫系統虛弱的環境,可能會使得R0值很高。然而,在生活環境品質和大眾健康狀況較好的人口中,R0值就低得多。 以更詳細的人群組成來分析,例如高風險人群的比例、和社會各族群人口的混合模式,也都會影響R0。續發性感染的平均人數,也會在疾病大流行中發生巨大變化,進而反映出傳染病在傳播時的有效再生數 (effective reproductive number)。這個數值會隨著個案為避免感染所作的行為改變而有所調整。
儘管有這些限制,研究疾病的再生數(reproductive number) 還是對了解疫情爆發很有幫助。舉例來說,哈佛大學的Stephen Kissler和ChristineTedijanto發現,當R0 =2.2時,美國民眾需要與至少70%的感染者,透過限制社交距離來減少 60%接觸次數,才可以避免各醫療單位的照護能力超載。牛津大學的 Luca Ferretti和Chris Wymant指出,當R0 = 2.0時, 唯有對75%的確診與疑似病例在兩天內實施隔離,疾病檢測與接觸史追蹤才能有效地控制疾病大流行。
在中國武漢疫情爆發的早期,美國Los Alamos國家實驗室的Steven Sanche 和 Yen Ting Lin計算出R0 = 5.7。而這個數值所相對應的疾病控制,則是需要隔離50%的感染者,並經由限制社交距離來減少50% 與感染者的接觸率。北京師範大學的Huaiyu Tian與其同事在疫情爆發初期時,估算出在中國城市的R0 = 3.1,但是在迅速實施疫情控制的城市中,R0值很快地降為1。在更嚴格的控制下,R0會進一步降至約0.04。
但是那些R0值從何而來? R0值的計算非常困難。 從單一個案開始的完整傳播路徑,很難被全面的觀察到。通常只有在感染者相對稀少、症狀較為獨特、可進行良好的診斷測試、並且可對大比例的人群進行採樣時, 才有可能做到這樣的計算(請參見圖1)。 在追蹤接觸史的研究中顯示,一旦個案被確診,公共衛生的專業人員便會追蹤該感染者在受感染期間可能接觸到的任何人,並對他們進行疾病檢測; 研究人員會使用這些數據來計算單一世代傳染的R0數值。
傳播動態
很少科學領域會有個單一指標參數如同傳染病流行病學的基本再生數R0 (basicreproductive number) 一樣,同時受到領域內外人士的大量關注。這個無單位數值指的是一個典型的感染者在易感染的族群中,可能平均會傳染給多少人 (即續發性感染 secondary infections)。這個數值可以用來描述某個疾病的傳染力高低、和評估疾病控制的難易度。(更多有關用模型來計算R0的資訊,請參見box 1。)
傳染病動態的研究中顯示,在臨界狀態或是某些行為門檻下,傳染病才會開始傳染。就像核鏈反應一樣,如果沒有達到某些條件,疫情就不會爆發。 R0值可以決定將會發生什麼結果。 如果疾病傳播是以連續微分方程來建模,那麼R0值可以決定何時會出現穩定或不穩定的平衡狀態。如果疾病的傳播是以一連串隨機的反應來建模,那麼R0值會關係著疾病未來比較可能會消失或是繼續發展。
大致上來說,R0取決於三個因素:(1)接觸率,就是感染者每天接觸的人數;(2)傳染力,就是在單位時間內與給定的感染者接觸而受到傳染的機率;(3)感染持續的時間。大多數傳染病控制的工作目標,就是藉由改變上述的一個或多個因素來降低R0值。例如, 可以藉由限制大眾的社交距離或針對個案作隔離,來降低與感染者的接觸率。再者可以通過戴口罩等措施,來減少與感染者互動中受到感染的機會,進而降低傳染力。 (有關更多呼吸道感染傳播的物理學相關資訊,請參見Stephane Poulain和Lydia Bourouiba 所寫的 ”Quick Study”,Physics Today, May 2019, p.70)。而感染持續的時間通常可以經由微生物清除療法來減少,例如用抗生素治療咽喉炎。但是目前還沒有適用於COVID-19的這類藥物。
然而,最終還有一種可以用來降低R0的方法,就是使用疫苗來減少受感染的個案數量。
作為一個指標, R0有若干個重大的限制。首先,它不會告訴我們這個疾病有多致命。例如有些感染的R0值較小,卻可能非常致命,像是SARS(嚴重急性呼吸道症候群);有些感染的R0值較大, 卻很少導致死亡,例如水痘; 另外還有一些感染,同時具有很高的R0值和很高的死亡風險,例如天花。 再者,R0並不能反映出疾病傳播的時間尺度。有些R0所描述的新病例平均數量可能是在幾天之內發生的,就像普通感冒一樣。但也有像典型的愛滋病毒這種會持續很多年的疾病。
與一般大眾認知相反,R0並不像用來表徵流體特性的雷諾數(Reynolds number),它無法反映出感染的原始特性。R0的量測有很大部分取決於疾病的傳播環境。 同樣的傳染病,若發生在人口擁擠、衛生條件差、和因營養不良造成免疫系統虛弱的環境,可能會使得R0值很高。然而,在生活環境品質和大眾健康狀況較好的人口中,R0值就低得多。 以更詳細的人群組成來分析,例如高風險人群的比例、和社會各族群人口的混合模式,也都會影響R0。續發性感染的平均人數,也會在疾病大流行中發生巨大變化,進而反映出傳染病在傳播時的有效再生數 (effective reproductive number)。這個數值會隨著個案為避免感染所作的行為改變而有所調整。
儘管有這些限制,研究疾病的再生數(reproductive number) 還是對了解疫情爆發很有幫助。舉例來說,哈佛大學的Stephen Kissler和ChristineTedijanto發現,當R0 =2.2時,美國民眾需要與至少70%的感染者,透過限制社交距離來減少 60%接觸次數,才可以避免各醫療單位的照護能力超載。牛津大學的 Luca Ferretti和Chris Wymant指出,當R0 = 2.0時, 唯有對75%的確診與疑似病例在兩天內實施隔離,疾病檢測與接觸史追蹤才能有效地控制疾病大流行。
在中國武漢疫情爆發的早期,美國Los Alamos國家實驗室的Steven Sanche 和 Yen Ting Lin計算出R0 = 5.7。而這個數值所相對應的疾病控制,則是需要隔離50%的感染者,並經由限制社交距離來減少50% 與感染者的接觸率。北京師範大學的Huaiyu Tian與其同事在疫情爆發初期時,估算出在中國城市的R0 = 3.1,但是在迅速實施疫情控制的城市中,R0值很快地降為1。在更嚴格的控制下,R0會進一步降至約0.04。
但是那些R0值從何而來? R0值的計算非常困難。 從單一個案開始的完整傳播路徑,很難被全面的觀察到。通常只有在感染者相對稀少、症狀較為獨特、可進行良好的診斷測試、並且可對大比例的人群進行採樣時, 才有可能做到這樣的計算(請參見圖1)。 在追蹤接觸史的研究中顯示,一旦個案被確診,公共衛生的專業人員便會追蹤該感染者在受感染期間可能接觸到的任何人,並對他們進行疾病檢測; 研究人員會使用這些數據來計算單一世代傳染的R0數值。
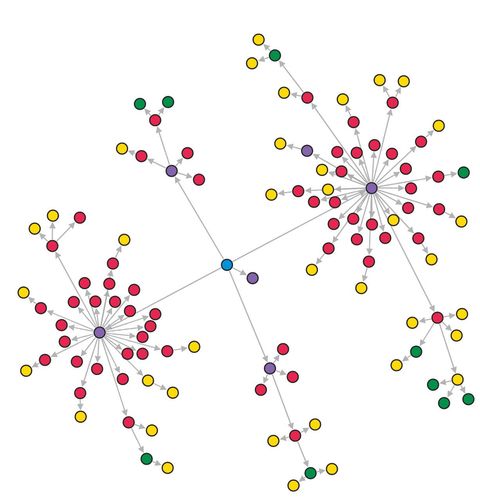
圖1. COVID- 19的傳播網絡示例。這個群聚傳染是由一個未知的感染個案(藍色)開始傳播的,該個案與其他健身教練(紫色)一起參加了培訓課程。 他們進而將感染傳播給課上課的學生(紅色),接著傳給家庭成員(黃色)和同事(綠色)。(圖片是使用參考文獻8中的軟體程式所畫)
但是直接計算R0 有可能會產生偏差。 例如,當一個爆發事件疑似是由單一感染源傳染給很多人的時候(即一個超級傳播事件),此時R0值就有可能會被高估。另一種可能是,參與研究的個案可能比一般人更容易迅速地被診斷和隔離,進而導致低估了真實的R0值。 因此,間接的計算R0則更為普遍,而且可能會得到更具代表性的結果。
一個間接計算R0的常見方法,是觀察流行性傳染病的成長率。只依據 R0 並不能決定疾病的傳播速度,還必須取決於個案具有感染力的時間尺度。 然而,如果可以確定個案具有感染力的平均時間,那麼通常可以從疾病傳播率中藉由一些數學技巧來算出群體的R0(見box 1)。

感染的時間尺度
感染數量的指數型成長,是流行性傳染病早期發展時的一個決定性的特徵。而估算成長率r、或者倍增時間T2 = log(2)/r,可以為流行性傳染病提供短期的預測依據。
就像R0一樣,r並不是傳染病的原始特性; 它會隨地區和時間而變化。 一般來說,r發生變化的原因與R0相同,例如人類改變行為以減少疾病傳播。 但是r的計算也會受到其他因素的影響。 由於確診與通報個案的數量比例改變、或是個案通報延遲,進而造成檢測量能的巨大變化,這些都有可能導致r計算上的偏差。
藉由觀測到的指數型成長率來回推 R0值,可以更直觀的解釋疫情,而且更直接地與潛在的疾病傳播歷程有關。研究人員以在不同傳染途徑的假設下,推導出了r與R0關係式(見box 1)。 一般來說,這些公式的推導需要幾個已知條件:(1)典型個案具有傳染力的時間長短 (即傳染期),以及 (2)從被感染到具有傳染力之間的延遲時間(即潛伏期)(見圖2)。 如果潛伏期或
傳染期較長,則我們會觀察到較高的感染指數成長率,而且推導出較高的R0值。然而,如果這兩種時間間隔都比較短,那麼推導出來的R0值就可能會小得多。
疾病的潛伏期和傳染期 (infectious periods)可以從追蹤個案已知的感染力暴露時間來估計。但是,我們不僅需要知道這些時間間隔的平均持續時間決定r和R0之間的關係還需要足夠多的病患才能在統計上合理的計算出完整的分佈曲線。
很多傳染病的潛伏期和傳染期很容易區別,因為它們各有其相對應的病徵來幫助辨別。 但是,COVID-19並非如此:個案經常在其呼吸道分泌物中釋放病毒,並且在出現咳嗽或發燒等症狀之前就具有高度傳染力。 因此,在症狀潛伏期(incubation period,即從受感染到出現症狀的時間)通常比傳染力潛伏期 (latent period) 更長(見圖2)。 此外,COVID-19的症狀也會持續很長一段時間,甚至超過傳染期很久症狀都還在。 因此,比起症狀追蹤,我們更需要流行病學的知識來評估個案何時開始具有傳染力。
傳染病流行病學家通常會觀察疾病傳播鏈來決定病程中具有傳染力的時刻。 我們可以用兩種方法來估計:(1) 透過感染世代間隔 (generation interval) ,即從一個人被感染,到他傳染給下一個人的時間間隔,或是(2)透過發病世代間隔 (serial interval),就是從一個感染者出現症狀,到下一個被感染者出現症狀之間的時間(見圖2)。 其中發病世代間隔 (serial interval) 更常被使用,因為個案症狀的發作通常比受感染更容易被識別出來。
感染數量的指數型成長,是流行性傳染病早期發展時的一個決定性的特徵。而估算成長率r、或者倍增時間T2 = log(2)/r,可以為流行性傳染病提供短期的預測依據。
就像R0一樣,r並不是傳染病的原始特性; 它會隨地區和時間而變化。 一般來說,r發生變化的原因與R0相同,例如人類改變行為以減少疾病傳播。 但是r的計算也會受到其他因素的影響。 由於確診與通報個案的數量比例改變、或是個案通報延遲,進而造成檢測量能的巨大變化,這些都有可能導致r計算上的偏差。
藉由觀測到的指數型成長率來回推 R0值,可以更直觀的解釋疫情,而且更直接地與潛在的疾病傳播歷程有關。研究人員以在不同傳染途徑的假設下,推導出了r與R0關係式(見box 1)。 一般來說,這些公式的推導需要幾個已知條件:(1)典型個案具有傳染力的時間長短 (即傳染期),以及 (2)從被感染到具有傳染力之間的延遲時間(即潛伏期)(見圖2)。 如果潛伏期或
傳染期較長,則我們會觀察到較高的感染指數成長率,而且推導出較高的R0值。然而,如果這兩種時間間隔都比較短,那麼推導出來的R0值就可能會小得多。
疾病的潛伏期和傳染期 (infectious periods)可以從追蹤個案已知的感染力暴露時間來估計。但是,我們不僅需要知道這些時間間隔的平均持續時間決定r和R0之間的關係還需要足夠多的病患才能在統計上合理的計算出完整的分佈曲線。
很多傳染病的潛伏期和傳染期很容易區別,因為它們各有其相對應的病徵來幫助辨別。 但是,COVID-19並非如此:個案經常在其呼吸道分泌物中釋放病毒,並且在出現咳嗽或發燒等症狀之前就具有高度傳染力。 因此,在症狀潛伏期(incubation period,即從受感染到出現症狀的時間)通常比傳染力潛伏期 (latent period) 更長(見圖2)。 此外,COVID-19的症狀也會持續很長一段時間,甚至超過傳染期很久症狀都還在。 因此,比起症狀追蹤,我們更需要流行病學的知識來評估個案何時開始具有傳染力。
傳染病流行病學家通常會觀察疾病傳播鏈來決定病程中具有傳染力的時刻。 我們可以用兩種方法來估計:(1) 透過感染世代間隔 (generation interval) ,即從一個人被感染,到他傳染給下一個人的時間間隔,或是(2)透過發病世代間隔 (serial interval),就是從一個感染者出現症狀,到下一個被感染者出現症狀之間的時間(見圖2)。 其中發病世代間隔 (serial interval) 更常被使用,因為個案症狀的發作通常比受感染更容易被識別出來。
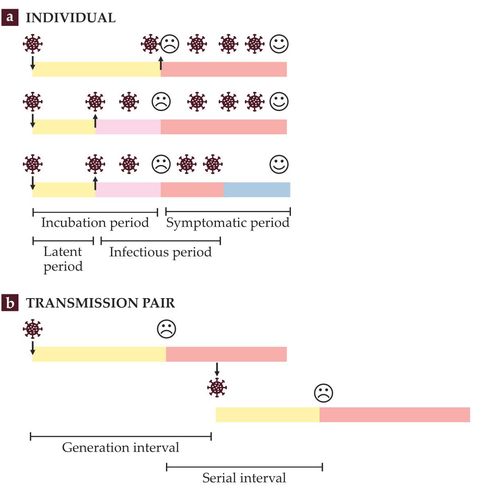
圖2. 流行病傳播的時間尺度。
(a)感染傳播的動力取決於感染個案的疾病進展時間。 症狀潛伏期開始於受到感染(向下箭頭),結束於症狀發作(哭喪臉)。 症狀期從症狀發作開始,以症狀消失(笑臉)結束。 相反的,傳染力潛伏期和傳染期是由感染者何時會將疾病傳播給他人(病毒符號)來決定,而且這些時期與症狀發生的時間不一定相關。 這張圖展示了三種可能的情況。在時間軸上可以看到COVID-19在這三種情況下的時間間隔標示。 (b)傳播實驗組(一組感染者與被其傳染的個案)通常用來估計個案受感染的世代間隔 (generation interval)、或是發病的世代間隔 (serial interval) 時間尺度。 (圖由Alison Hill 所繪)
發病世代間隔是症狀潛伏期與傳染期的數學卷積。 如果其中一個數值已知,就可以計算出另外一個數值。研究人員已經發展出一個與r和R0直接相關的發病世代間隔分佈公式。而且這個公式不需要已知的個案潛伏期與傳染期。 這些公式已經成為計算R0最常用的方法。 但是在計算發病世代間隔過程中,R0可能有所偏差。 例如,參與研究的個案通常在被確診後不久就被隔離,這就減少了他們感染其他人的時間。
計算感染各階段的持續時間,可以為流行病控制提供除了R0以外的資訊。 從症狀潛伏期的分佈中能看出暴露的個案需要被隔離多久才可以安全地排除症狀性感染。 而傳染期的分佈則可以決定應該將感染者隔離多久,才可以防止他們去感染他人。
有多致命?
到目前為止,我們已經使用基本再生數 R0來描述流行病的特徵,而且也大概描述了一個感染者的潛在傳播途徑。r 值的指數成長率顯示出流行病的快速成長;而感染的時間間隔則可以說明個案的病程發展如何決定群眾受感染的時間尺度。但是這個指標還缺少一個關鍵特徵:這個疾病有多致命?
傳染病的致死程度通常被定義為受感染的個案最終死於該疾病的可能性,我們通常稱之為確診病例死亡風險(case fatality risk, 縮寫為CFR;詳見box 2)。COVID-19的CFR引起了大眾激烈的爭論,儘管科學家已經將致死率的數值收斂在1%左右,但研究員、媒體、和大眾仍然持續地詳細研究這個數值。 有些人堅持COVID-19只是「另一種流感」,而有人則是提出了遠遠超過官方公布的死亡人數的證據。 要了解這個議題的爭論點,最重要的是要先了解CFR計算上的複雜性。
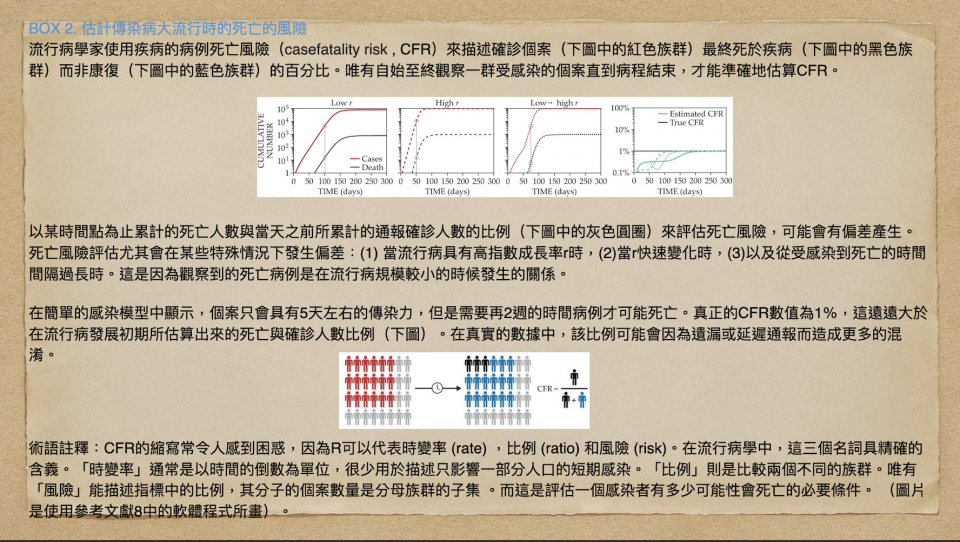
在計算疾病的CFR時有一個常見錯誤,就是將某天以前累計的死亡總數除以同一天之前所累計的確診病例總數。 這個比例在計算上是針對已知的感染者去估計其死亡的可能性 (特別是在快速成長的流行病期間),因此會產生數值上的偏差。(有關這一點的說明, 請詳見box 2 的簡單模型圖示)為了正確地探究死亡風險,研究人員可以使用世代研究 (cohort Studies),觀察一組近期受感染的個案,直到每個人康復或死亡為止。 但是在疾情爆發的期間很難進行這樣的研究。因此另一種可行的方式,是根據流行病的成長和消亡時間來調整簡易死亡比例的數值。
另一個在計算CFR時要考慮的複雜因素是要決定病例樣本。在流行病學的文獻裡關於CFR的定義清楚的指出,所謂「病例」,是通過特定檢測或是至少根據症狀而被確診感染的人。 但對於像COVID-19這樣的感染來說,由於真實的病例會因為檢測限制和無症狀感染而被遺漏,因此這樣的定義反而是個問題。 如果研究人員真的想估計感染後死亡的可能性,那麼他們必須要修正被低估的感染人數,並且將所估計的數值更正確地稱作感染死亡風險(infection fatality risk, 縮寫為IFR)。要計算被低估的程度,並得到COVID-19 的IFR,流行病學家不是要對群眾進行普篩,就是要對人群進行隨機檢測,這樣才可以評估當前或過去感染的的盛行率(prevalence)。
其他的挑戰例如正確判定死亡原因,也會影響研究人員去估計和解析COVID-19和其他感染的CFR 和IFR。 然而更重要的是,像CFR這樣的指標僅僅只是統計死亡人數而已;它們並不包含倖存者所遭受到的其他傷害。 COVID-19的長期併發症和嚴重病例所需的護理(例如呼吸器)仍然還需要更多的研究,而簡單的數值指標不太可能會納入這些因素的影響。
從敘述到預測
像R0、r、和CFR這樣的指標,有助於對感染進行分類和比較,並且能快速地傳達可能的風險。 但是它們預測流行病的照護負荷量的能力有限。 例如,感染會導致多少人死亡以及其發生的時間長短,這不僅取決於CFR,還取決於有多少人受到感染。而這些因素本身正仰賴於感染傳播的難易程度、易受感染人群比例的多寡、以及控制措施的有效性。 每天新感染的人數則是取決於當前已受感染的人數以及他們受到感染的時間長短。而這也決定了這些感染者中有多少人已經進入了傳染期。 因此我們需要數學模型,將這些變因組合在一起並作出明智的預測。
倉室模型 (compartmental model) 是大多數被用來追蹤群眾感染傳播的動態模型。在這種模型中,個案會根據他們受感染的階段被分類到某一種離散狀態,例如易受感染的族群、已受感染的族群、和已復原的族群 (請見圖3)。這個模型常使用微分方程、離散、或是連續隨機過程來追蹤個案人數在各階段的變化。這些方程式在本質上是非線性的,因為易感染個案和受感染個案之間的成對相互作用會造成新的感染發生。
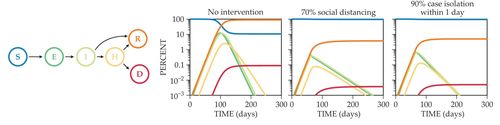
圖3. 比較有無施行防疫措施的COVID-19傳播模型。 這裡所展示倉室模型把個案分為易感染族群(S),暴露於感染環境的族群(E),具傳染力的族群(I),住院治療的族群(H),和康復(R)或死亡(D)的族群。 在第60天,實施了兩種防疫措施:(1) 透過限制社交距離的政策將感染者和易感染個案之間的接觸減少70%,或者 (2) 以確診為基礎所實施政策,將90%的感染者在其具有傳染力之後平均一天實施隔離。(使用參考文獻8中的代碼創建的圖像。)
物理學家們可能會在動態系統導論的課程中學過一些簡單的標準流行病模型,並且以其倉室的縮寫命名。 例如SIS模型所描述的感染就像許多性傳染病一樣,不會產生長期的免疫力:易感染(S)的個案可以變成受感染(I)的個案,但在復原之後又回到易感染的狀態。 在SIR模型中,會假設復原(R)後的個案是永久免疫的,這很類似許多短期的病毒感染(如麻疹或黃熱病)。 (可使用倉室SIR模型的線上模擬工具來了解COVID-19的傳播途徑:https://alhill.shinyapps.io/COVID19seir)
就如同物理學家一樣,傳染病研究人員也在「建立簡單易懂的模型」與「作出有用的預測」之間保持平衡。 倉室模型總是過度簡化,但實際上人類體內的感染狀態是連續的變化:即微生物先在身體組織之間繁殖和移動,使得免疫系統產生反應,接著身體就出現症狀。 而疾病傳播的過程比許多方程式中用的簡單反應率,可能還要複雜得多。因為這仰賴於個人的接觸史和高度結構化的社交網絡本質(請參見box 3)。

建立模型時,在細節程度上的需求則是取決於使用的目的。有些對COVID-19建模的研究人員,對了解健康照護系統的潛在負荷很有興趣,因此他們將SIR模型延伸到需要進階照護的感染階段,包括住院或進入加護病房。 他們也對死亡個案的部分進行追蹤(見圖3)。 在對限制社交距離提出政策建議的研究中,建模人員模擬詳細的感染網絡,這些網絡描述了個案在家庭、學校、工作中與朋友的互動。 為了要了解以症狀為基礎的隔離加上 (或不加) 額外的居家檢疫政策是否有效,科學家因而擴展了基本模型來追蹤病程的傳染力。
科學家一直在爭論對於COVID-19不同建模方法的相對優缺點。 他們隨著對疾病變化的了解來優化模型,並試著以最好的方式向公眾傳達模型預測中本來就存在的不確定性。 (更多有關COVID-19建模中不確定性的資訊,請參閱《 Physics Today》,2020年6月,第25頁。)
數學分析和建模是研究傳染病的重要工具,而且對於因應COVID-19大流行的策略也扮演著十分關鍵的角色。 在我們計算看似簡單的指標時(如R0、CFR、潛伏期和傳染期),更需要嚴謹地注意數據中的細微差別,並且小心翼翼地把數學關係公式化。 在設計流行病動態的複雜模型時,建模人員需要在「簡單易理解」和「足以符合現實來作出準確預測」之間的保持平衡。而計算出正確的數值始終是科學家的首要任務。在公共衛生爆發危機的期間,這些風險比以往都要高。
更正:在這篇文章的更新聲明中指出, 是Daniel Bernoulli 在1760年設計了一個模型來預測天花接種的益處,而非原文章提到的 David。 此外,在box 1中,作者修正了負二項分佈(negative binomial distribution),以 Γ(k+1) 取代原本的 Γ(k)。
參考資料:
1.S. P. Otto, T. Day, A Biologist’s Guide to Mathematical Modeling in Ecology and Evolution, Princeton U. Press (2007). Google ScholarCrossref
2.N. Bacaër, in A Short History of Mathematical Population Dynamics, Springer (2011), p. 21. Google ScholarCrossref
3.S. Mandal, R. R. Sarkar, S. Sinha, Malar. J. 10, 202 (2011). https://doi.org/10.1186/1475-2875-10-202, Google ScholarCrossref
4.J. M. Heffernan, R. J. Smith, L. M. Wahl, J. R. Soc. Interface 2, 281 (2005). https://doi.org/10.1098/rsif.2005.0042, Google ScholarCrossref
5.M. J. Keeling, P. Rohani, Modeling Infectious Diseases in Humans and Animals, Princeton U. Press (2008). Google ScholarCrossref
6.E. Vynnycky, R. G. White, An Introduction to Infectious Disease Modelling, Oxford U. Press (2010). Google Scholar
7.S. Jang, S. H. Han, J.-Y. Rhee, Emerg. Infect. Dis. 26, 1917 (2020). https://doi.org/10.3201/eid2608.200633, Google ScholarCrossref
8.All the code used to generate the results shown in this article and details about the methods used are publicly available at https://github.com/alsnhll/PhysicsTodayCOVID19. Google Scholar
9.J. O. Lloyd-Smith et al., Nature 438, 355 (2005). https://doi.org/10.1038/nature04153, Google ScholarCrossref
10.J. Wallinga, M. Lipsitch, Proc. R. Soc. B. 274, 599 (2007). https://doi.org/10.1098/rspb.2006.3754, Google ScholarCrossref
11.J. C. Miller, J. R. Soc. Interface 6, 1121 (2009). https://doi.org/10.1098/rsif.2008.0524, Google ScholarCrossref
本文感謝Physics Today (American Institute of Physics) 同意物理雙月刊進行中文翻譯並授權刊登。原文刊登並收錄於Physics Today, Nov. 2020 雜誌內 (Physics Today 73, 11, 28 (2020); https://doi.org/10.1063/PT.3.4614)。原文作者: Alison Hill, 。中文編譯:徐麗婷博士
Physics Bimonthly (The Physics Society of Taiwan) appreciates that Physics Today (American Institute of Physics) authorizes Physics Bimonthly to translate and reprint in Mandarin. The article is contributed by Alison Hill, and is published on (Physics Today 73, 11, 28 (2020); https://doi.org/10.1063/PT.3.4614). The article in Mandarin is translated and edited by Li-Ting Hsu.