
用物理和數學方法洞悉癌症的形成與蔓延
- Physics Today 專文
- 撰文者:朱家誼譯
- 發文日期:2020-03-03
- 點閱次數:1228
癌細胞會存活、成長還是休眠或多或少都與力學和其他物理現象相關
雖然某些癌症的預後 (prognosis) 技術已經進步了,但從 1971 年「向癌宣戰」(war on cancer) 的宣言開始後在治療方面的發展卻沒有太多。心臟疾病和癌症目前在美國是主要死因,而隨著美國的人口逐漸老化,癌症死亡的人數預計也會跟著上升。先不管癌症的致命率和長久的謎團,光是發現癌細胞除了會對化學和遺傳信號產生反應外,也會被物理和力學機制影響。這就讓許多物理相關領域的科學家開始研究起這種疾病。
雖然從歷史的角度來看,物理學家本來就對發展許多檢測或治療癌症的工具都有重要貢獻,包含從 X 光和核磁共振造影 (MRI) 到雷射、放射治療和狡詐家藥物 (designer drug);但過去十年開始,忽然有越來越多物理科學家和工程師投身研究這種疾病、進入這本來這幾乎是生物學家和醫學研究員獨佔的領域。

圖一、德國萊比錫大學約瑟夫·卡斯實驗室裡的一個碩士生正在看螢光標記的腫瘤圖像。
十年前在美國國家癌症研究所 (NCI, National Cancer Institute) 成立自然科學與腫瘤學中心 (Physical Science-Oncology Centers) 的關鍵人物 (請參閱 Physics Today 2014 年十一月號第 22 頁的介紹), 同時也是現任亞利桑那州立大學 (Arizona State University) 複雜適應性系統網路 (Complex Adaptive Systems Network) 聯席主任的安娜·芭可 (Anna Barker) 說物理科學家已經對於瞭解癌症的貢獻非常地多,包含找出最相關的數據、用更多的數學工具分析這些數據和建立有用的理論,這些進展即將成為強大的工具了。甚至現在物理科學和資訊理論已經成為了「癌症研究新領域」。
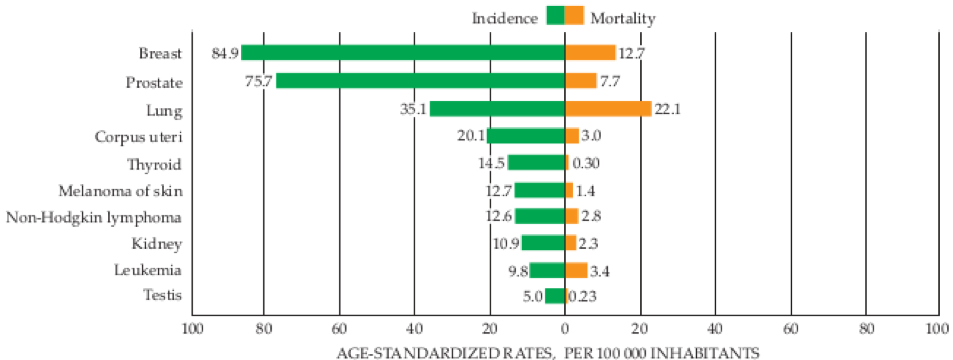
圖二、美國各種不同癌症的發生率與死亡率。(Reproduced with permission from J. Ferlay et al., Global Cancer Observatory: Cancer Today, International Agency for Research on Cancer, 2018. Available from the interactive website https://gco.iarc.fr/today, accessed 14 May 2019.)
物理科學家從研究癌症的角度五花八門,包含了組織 (tissue) 硬度與癌症的關聯性,癌細胞如何改變生存環境、與健康細胞的差異、和遷移、選擇及生成於要轉移的部位,蛋白質是否是種機械一化學開關,和如何改善預後的預測能力等。而研究人員們研究的方式更是千變萬化,譬如用數學和電腦計算模型、機器學習、系統工程、腫瘤細胞的二維及三維培養、動物實驗和人體臨床實驗。德國萊比錫大學 (University of Leipzig in Germany) 的生物物理學家約瑟夫·卡斯 (Josef Käs) 表示則這樣廣泛的研究可以幫助癌症研究建立更完整的圖像,「癌症研究是個錯綜複雜的課題,瞭解單一問題對癌症的理解作用並不大,不過即便如此我們還是一天天的更瞭解它了。」
對健康細胞動手腳的癌症
對物理科學家來說其中一個可以著手瞭解癌症的地方就是腫瘤的形成。NCI 裡的一位物理學家坎迪斯·坦納 (Kandice Tanner) 就用斑馬魚 (zebrafish) 研究癌症對轉移的器官選擇性 (見圖三),目標是要找出是什麼物理性質,讓癌症選擇出現的部位和微環境對細胞存活、成長或休眠的影響。有時候沒有些受過專業生物訓練反而可以提供不同的想法。她說「不過還是得小心的驗證這些想法是否真的合理。」(也可以到 http://physicstoday.org/tanner 閱讀與坦納的訪談瞭解關於她的研究和職涯。)
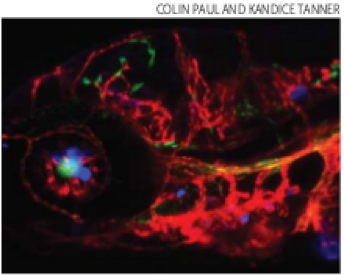
圖三、人類乳癌細胞注射到斑馬魚 (zebrafish) 身上,結果他們就散布並定植 (colonize) 在腦部 (藍色部份)。
位於西班牙巴塞隆納的加泰羅尼亞生物工程研究所 (Institute for Bioengineering of Catalonia in Barcelona, Spain) 一位團隊負責人哈維爾·特勒帕 (Xavier Trepat) 專注在力學與癌症發展的關係,譬如在轉移時細胞從原發性腫瘤 (primary tumor) 脫離、在組織間遷移、隨著血液和淋巴系統遷移最終移至繼發性腫瘤上。特勒帕說每一個步驟都會牽扯到很多的蛋白質和基因,而這些步驟也會有力學過程。癌細胞要進到血管時需要將其他的細胞擠開並且要自我形變,而他的實驗室則可以用試管實驗量測這些過程所需的力。
健康的細胞會使用 1~100 納牛頓 (nN) 讓自己移動,這同時也會傳遞生物訊號,使其他細胞分泌蛋白質、表現基因 (express a gene)、分裂、死亡或做其他動作。但癌細胞會沒收這些訊號讓細胞無法做該做的事。
在特勒帕的實驗中,腫瘤和健康的細胞被混合在一起,「因為腫瘤任何行為都會被非腫瘤細胞影響。」他的團隊發現皮膚癌細胞本身其實沒有行動力,而是利用負責分泌膠原蛋白和其他大分子形成結締組織,並幫助癒合傷口的健康纖維母細胞 (fibroblast) 的活動力移動。當癌細胞黏附在纖維母細胞上就可以從腫瘤裡分離出來。「可以說腫瘤細胞為了遷移而綁架了纖維母細胞的功能,」他說,「就是這種健康細胞和癌細胞之間的串擾 (cross talk) 最終造成癌擴散。」
許多類型的腫瘤比一般組織還要硬,因此癌症往往可以用觸診診斷出來。當組織纖維的交叉鏈接 (cross-link) 越來越多、被撐大或因癌細胞增生密度變高而變硬。而腫瘤變大時局部壓力也會隨著變大,偏偏癌細胞比起正常細胞更能承受這樣的環境。
特定位置的組織硬度本來就可以用超音波或核磁共振彈性圖相儀量測到;最近維歐拉·沃格爾 (Viola Vogel) 和她蘇黎世聯邦理工學院 (ETH Zürich) 的團隊進一步合成出的一種只與放鬆組織纖維結合的肽 (peptide)。根據沃格爾的講法,這種選擇能力使研究人員終於可以分辨放鬆和延展的纖維。「沒想到我們發現腫瘤組織裡有許多的放鬆纖維。既然還沒人懂健康和病變組織的纖維張力,我們必須從生理學上來理解它。」她也補充道這種肽也許可以在化療後拿來辨識和瞄準化療後殘存的病變纖維。
切除下來的腫瘤和周遭的健康組織可以在拉伸和拉緊的狀況下進行比較。舉例來說,肝癌細胞在比較硬的基質上比軟的還要容易增生且會喪失肝特徵。自然科學與腫瘤學中心之一的中心主任—賓州大學 (University of Pennsylvania) 生物物理學家丹尼斯·迪瑟 (Dennis Discher) 就說大概在 2000 年左右時研究人員就已經知道組織的軟硬度對健康程度很重要,不論原因是酗酒、病毒、肝硬化、肝纖維化或其他原因使肝臟開始變硬時,形成肝癌的機會就高。
丹麥哥本哈根大學 (University of Copenhagen in Denmark) 的癌症生物學家珍寧·埃勒爾 (Janine Erler) 說細胞外基質 (extracellular matrix) 硬化會導致癌化。她和在同校尼爾斯·波耳研究所 (Niels Bohr Institute) 任職的物理學家萊娜·奧德爾赦德 (Lene Oddershede) 將健康和癌細胞植入膠原蛋白基質 (collagen matrix) 並用光鑷 (optical tweezer) 來測量細胞硬化程度和組織密度的關係。奧德爾赦德說雖然基質密度 (matrix density) 不會改變健康的細胞,但是有侵略性的癌細胞就會隨著基質的僵硬程度變軟或變硬。埃勒爾表示:「在比較硬的微環境裡細胞會比較有侵略性。」不過目前我們還不清楚到底是基質硬化導致細胞具有侵襲性還是細胞的侵襲性造成基質硬化。
只有具侵襲性的癌細胞可以透過細孔擠進周圍的組織基質,埃勒爾的目標是要瞭解控制細胞行為的機制為何,也就是說下令細胞侵襲或無視藥物的源頭到底是什麼。埃勒爾說:「如果我們可以瞭解細胞怎麼知道周圍是僵硬環境,或許我們就可以改變細胞的反應。如此一來我們就有機會可以誤導細胞讓它們以為自己是處於柔軟的環境裡。」
卡斯和他在萊比錫的團隊觀查從乳房癌和子宮頸癌病患切下的腫瘤塊。他們發現有些區塊超過一半是不會移動的球狀細胞,而這些區塊間會有液態區讓這些細胞流到腫瘤表面並離開,就像膠質的堵塞—非堵塞轉變 (jamming-unjamming transition)。他說:「細胞可以透過形狀改變影響成為堵塞或非堵塞的狀態。換句話說,這是集體行為造成的現象,而不是單一細胞能夠控制地。」 (可參閱 Physics Today 2019 年二月號第 38 頁由 Robert Evans、Daan Frenkel 和 Marjolein Dijkstra 的文章及 2010 年十月號第 64 頁 Jasna Brujic 的文章。) 卡斯又補充道,病理學研究認為許多球形細胞的腫瘤做的預後比較精準,而有細長的細胞就有可能有轉移的情形。
殺人於無形的癌細胞轉移
一般來說,病人必須在癌細胞還沒轉移之前,就把原發性腫瘤移除才有辦法痊癒。即便如此,癌細胞還是有可能已經默默地散布出去,且造成未來復發的可能性。對普林斯頓大學 (Princeton University) 的物理學家羅伯特·奧斯丁 (Robert Austin) 來說,最迫切的問題是瞭解癌症如何轉移。「百分之九十的癌症死亡案例都是因為癌症轉移造成的」,他說:「這才是關鍵。」 (請參閱 Physics Today 2014 年二月號第 26 頁由 Chwee Teck Lim 和 Dave Hoon 所寫的文章。)
腫瘤是個高度嚴苛的環境:酸性、缺氧、養分也不足。奧斯丁的團隊將細胞放在微製造技術製成的矽基質上改變各種不同環境條件,如藥的分佈、液體的流向等,紀錄細胞的遷移過程。他說,他們將轉移細胞系混合在一起希望「越有普適性越好」。
這些在這種最嚴酷的環境下生存下來的細胞會成為多倍體 (polyploid)—他們會吞噬其他細胞並擁有多種不同細胞種類的染色體 (請見圖四)。「這已經不是單純的前列腺、骨髓或乳房癌細胞了」,奧斯丁說,這種混合方式其實是個「讓癌細胞有更多方處理難題的方法」的一種生存策略。他建議的一個新治療方法就是把藥物瞄準有多倍體核的細胞和核變成多倍體的過程。
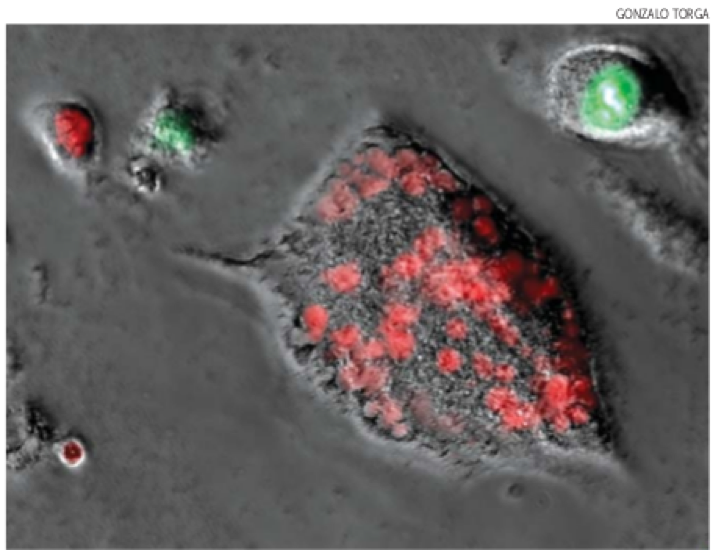
圖四、這個轉移的前列腺癌細胞有超過三十種的染色體,是綜合了吞食異質細胞核和暴露在化療藥物下類積的成果。這些紅色點是細胞核裡被螢光標記的蛋白質。
范德比大學 (Vanderbilt University) 生醫工程系的辛西婭·萊因哈特金 (Cynthia Reinhart-King) 也使用了人造系統來研究癌症。她說:「我們可以將膠原蛋白製造成類似腫瘤膠原蛋白,也可以調整細孔和膠原蛋白的纖維大小。」有了這樣的系統,她的團隊可以試著找出細胞如何沿著纖維遷移和為什麼組織密度是乳癌的預後指標之類的問題。「我們的系統可以客製化成能研究有侵襲性細胞、組織結構角色和造成細胞遷移及成長機制是什麼的環境,也可以觀測單一和集體細胞的行為。」
萊因哈特金說物理學家和工程師最大的貢獻就是證明了疾病惡化並不是只有細胞本身有貢獻,她說:「我們認識到組織的結構、硬度、孔隙率和液體分佈都會對癌症的惡化有不小的影響。」。研究人員更進一步地發現微環境的狀況可以使正常細胞表現得像癌細胞、也可以讓癌細胞表現得像正常細胞。
萊因哈特金表示,轉移則是牽扯到領導者和追隨者 (leader-follower) 行為,其中有些細胞會帶領細胞離開原發性腫瘤。他和其他研究人員發現細胞的能量決定了誰帶路,而當帶路的細胞能量不夠時,其他的就會取而代之。不過一開始怎麼決定誰是領導者、誰是追隨者的機制還是待解之謎。除此之外還有個問題:如果一個原發性腫瘤每天可以散出上千個細胞,為什麼轉移器官相對起來這麼少?
預後的未來
美國東北大學 (Northeastern University) 的理論學家赫伯特·李維 (Herbert Levine) 分析癌細胞發出的信號以及其決策。(請參閱 Physics Today 2014年二月號第31頁 Jané Kondev 的文章。) 是什麼機制使細胞發出特別的信號?他們怎麼決定要遷移?李維舉了細胞骨架波形蛋白 (cytoskeletal protein vimentin) 為例,這種蛋白質只存在會遷徙的細胞裡,而當癌細胞開始可以運動時這種蛋白也會有可偵測量濃度改變,也就有可能是代表轉移的象徵。他考慮先從非常有限的變量開始建構動力學模型,然後根據癌症生物學家的建議加入更多的變量。他說:「我們想要瞭解各種參數跟細胞決定的關聯性。」不過這些結果其實算「模糊」,因為這並不是確切答案;不過好事情是這些結果可以被推廣到很多細胞系。
擔任西奈山計算免疫學中心 (Center for Computational Immunology at Mount Sinai) 主任的理論物理學家班傑明·格林鮑姆 (Benjamin Greenbaum) 專門研究免疫力驅動的腫瘤演化,和腫瘤對於開啟或壓抑身體免疫系統的抗癌療程反應。譬如說,為什麼免疫治療對於一部分的黑色素瘤 (melanoma) 轉移病患無效,但對其他人卻可以把疾病去除?他也同時是個由「對抗癌症 (Stand Up To Cancer)」 慈善機構所資助的跨領域團隊裡的一員,負責研究為什麼有一小部份病人可以在罹患胰臟癌之後依然活非常久的時間。他和同事們建立了一個腫瘤演化的動力學模型,也比較了一些如突變造成這類可以被免疫系統辨識之腫瘤分子的變化,嘗試找到無反應病患的治療方法。(去年的諾貝爾生理醫學獎就是因為「發現以抑制負性免疫調節法治療癌症」頒給詹姆斯·艾利森 (James P. Allison) 和本庶佑。)
加州大學爾灣分校 (University of California, Irvine) 的理論物理學家克萊爾·余 (Clare Yu) 用統計方法分析三陰性乳癌 (triple-negative breast cancer,一種有侵襲性且荷爾蒙無關的癌症) 的免疫治療法效力,可以從病人體內免疫細胞的密度和分佈,評估病人對免疫治療的成效及復發的機率。她說:「我們有大約 70% 的準確率預測五年內是否會復發。」
余也對腫瘤出現位置的機制很有興趣。譬如有超過一半的乳癌都是在腋下出現、肺癌從上葉開始出現的比下葉出現的多兩倍、大腸癌則是偏好出現在大腸前半段。余說:「這不是隨機的,而是空間位置的問題,這是種物理性質。」他喜歡這個問題因為「這看不出來能不能用信號通路 (signaling pathways) 解釋,也就意謂著有些信號級毒素之外的東西需要放入考量。」
普林斯頓大學的奧斯丁也用理論方法估計和預測癌症的行為。他說結締組織裡癌細胞和非癌細胞之間的作用可以用非線性耦合偏微分方程描述。「這是種博奕理論。你可以嘗試預知未來、預測癌如何演化。」他說轉移目前還沒辦法被事先預料,但這類的計算可以拿來預估結果並避免過度治療。
在比利時和澳洲工作的病理學家羅伯托·薩爾加多 (Roberto Salgado) 說癌組織 (cancer tissue) 裡看得到的特徵遠比肉眼可見的更多。他結合了機器學習和空間基因組學 (spatial genomics,DNA 和 RNA 的位置和組織功能與基因訊息相關的基因組學) 的碎形分析 (fractal analysis) 方法,因為細胞核的形狀、染色質 (chromatin) 密度、癌細胞生長形式和血管樣式都可以當作病理學家用來區別有侵襲性和較沒侵襲性癌的變數。「機器學習正好可以與病理學家互補,」薩爾加多說,「我想我們需要解密更多的癌症結構複雜性,也就是癌症生態學背後的奧秘。如果我們做完發現癌的空間結構與基因組學一致,那我們就成功的幫我們的病人取得更進一步的發展。」
其實對癌症研究有良好進展的關鍵之一是如何增進生物學家、臨床醫師、病理學家和物理相關科學家之間的溝通。因此去年紀念斯隆凱特琳癌症中心 (Memorial Sloan Kettering Cancer Center) 的賴瑞·諾頓 (Larry Norton) ,和同事們開辦了私人贊助的數學腫瘤學提案 (Mathematical Oncology Initiative) 嘗試建造大家的共通語言且希望能夠用數學幫助癌症研究。
本文感謝Physics Today (American Institute of Physics) 同意物理雙月刊進行中文翻譯並授權刊登。原文刊登並收錄於Physics Today, August 2019雜誌內(Physics Today 72, 6, 26 (2019); https://doi.org/10.1063/PT.3.4223);原文作者:Toni Fefer。中文編譯:朱家誼 博士,國立中興大學物理系 博士後。
Physics Bimonthly (The Physics Society of Taiwan) appreciates that Physics Today (American Institute of Physics) authorizes Physics Bimonthly to translate and reprint in Mandarin. The article is contributed by Toni Feder, and are published on Physics Today 72, 6, 26 (2019); https://doi.org/10.1063/PT.3.4223). The article in Mandarin is translated and edited by Dr. Chia-Yi Ju, working on Department of Physics, National Chung Hsing University.
雖然某些癌症的預後 (prognosis) 技術已經進步了,但從 1971 年「向癌宣戰」(war on cancer) 的宣言開始後在治療方面的發展卻沒有太多。心臟疾病和癌症目前在美國是主要死因,而隨著美國的人口逐漸老化,癌症死亡的人數預計也會跟著上升。先不管癌症的致命率和長久的謎團,光是發現癌細胞除了會對化學和遺傳信號產生反應外,也會被物理和力學機制影響。這就讓許多物理相關領域的科學家開始研究起這種疾病。
雖然從歷史的角度來看,物理學家本來就對發展許多檢測或治療癌症的工具都有重要貢獻,包含從 X 光和核磁共振造影 (MRI) 到雷射、放射治療和狡詐家藥物 (designer drug);但過去十年開始,忽然有越來越多物理科學家和工程師投身研究這種疾病、進入這本來這幾乎是生物學家和醫學研究員獨佔的領域。

圖一、德國萊比錫大學約瑟夫·卡斯實驗室裡的一個碩士生正在看螢光標記的腫瘤圖像。
十年前在美國國家癌症研究所 (NCI, National Cancer Institute) 成立自然科學與腫瘤學中心 (Physical Science-Oncology Centers) 的關鍵人物 (請參閱 Physics Today 2014 年十一月號第 22 頁的介紹), 同時也是現任亞利桑那州立大學 (Arizona State University) 複雜適應性系統網路 (Complex Adaptive Systems Network) 聯席主任的安娜·芭可 (Anna Barker) 說物理科學家已經對於瞭解癌症的貢獻非常地多,包含找出最相關的數據、用更多的數學工具分析這些數據和建立有用的理論,這些進展即將成為強大的工具了。甚至現在物理科學和資訊理論已經成為了「癌症研究新領域」。

圖二、美國各種不同癌症的發生率與死亡率。(Reproduced with permission from J. Ferlay et al., Global Cancer Observatory: Cancer Today, International Agency for Research on Cancer, 2018. Available from the interactive website https://gco.iarc.fr/today, accessed 14 May 2019.)
物理科學家從研究癌症的角度五花八門,包含了組織 (tissue) 硬度與癌症的關聯性,癌細胞如何改變生存環境、與健康細胞的差異、和遷移、選擇及生成於要轉移的部位,蛋白質是否是種機械一化學開關,和如何改善預後的預測能力等。而研究人員們研究的方式更是千變萬化,譬如用數學和電腦計算模型、機器學習、系統工程、腫瘤細胞的二維及三維培養、動物實驗和人體臨床實驗。德國萊比錫大學 (University of Leipzig in Germany) 的生物物理學家約瑟夫·卡斯 (Josef Käs) 表示則這樣廣泛的研究可以幫助癌症研究建立更完整的圖像,「癌症研究是個錯綜複雜的課題,瞭解單一問題對癌症的理解作用並不大,不過即便如此我們還是一天天的更瞭解它了。」
對健康細胞動手腳的癌症
對物理科學家來說其中一個可以著手瞭解癌症的地方就是腫瘤的形成。NCI 裡的一位物理學家坎迪斯·坦納 (Kandice Tanner) 就用斑馬魚 (zebrafish) 研究癌症對轉移的器官選擇性 (見圖三),目標是要找出是什麼物理性質,讓癌症選擇出現的部位和微環境對細胞存活、成長或休眠的影響。有時候沒有些受過專業生物訓練反而可以提供不同的想法。她說「不過還是得小心的驗證這些想法是否真的合理。」(也可以到 http://physicstoday.org/tanner 閱讀與坦納的訪談瞭解關於她的研究和職涯。)

圖三、人類乳癌細胞注射到斑馬魚 (zebrafish) 身上,結果他們就散布並定植 (colonize) 在腦部 (藍色部份)。
位於西班牙巴塞隆納的加泰羅尼亞生物工程研究所 (Institute for Bioengineering of Catalonia in Barcelona, Spain) 一位團隊負責人哈維爾·特勒帕 (Xavier Trepat) 專注在力學與癌症發展的關係,譬如在轉移時細胞從原發性腫瘤 (primary tumor) 脫離、在組織間遷移、隨著血液和淋巴系統遷移最終移至繼發性腫瘤上。特勒帕說每一個步驟都會牽扯到很多的蛋白質和基因,而這些步驟也會有力學過程。癌細胞要進到血管時需要將其他的細胞擠開並且要自我形變,而他的實驗室則可以用試管實驗量測這些過程所需的力。
健康的細胞會使用 1~100 納牛頓 (nN) 讓自己移動,這同時也會傳遞生物訊號,使其他細胞分泌蛋白質、表現基因 (express a gene)、分裂、死亡或做其他動作。但癌細胞會沒收這些訊號讓細胞無法做該做的事。
在特勒帕的實驗中,腫瘤和健康的細胞被混合在一起,「因為腫瘤任何行為都會被非腫瘤細胞影響。」他的團隊發現皮膚癌細胞本身其實沒有行動力,而是利用負責分泌膠原蛋白和其他大分子形成結締組織,並幫助癒合傷口的健康纖維母細胞 (fibroblast) 的活動力移動。當癌細胞黏附在纖維母細胞上就可以從腫瘤裡分離出來。「可以說腫瘤細胞為了遷移而綁架了纖維母細胞的功能,」他說,「就是這種健康細胞和癌細胞之間的串擾 (cross talk) 最終造成癌擴散。」
許多類型的腫瘤比一般組織還要硬,因此癌症往往可以用觸診診斷出來。當組織纖維的交叉鏈接 (cross-link) 越來越多、被撐大或因癌細胞增生密度變高而變硬。而腫瘤變大時局部壓力也會隨著變大,偏偏癌細胞比起正常細胞更能承受這樣的環境。
特定位置的組織硬度本來就可以用超音波或核磁共振彈性圖相儀量測到;最近維歐拉·沃格爾 (Viola Vogel) 和她蘇黎世聯邦理工學院 (ETH Zürich) 的團隊進一步合成出的一種只與放鬆組織纖維結合的肽 (peptide)。根據沃格爾的講法,這種選擇能力使研究人員終於可以分辨放鬆和延展的纖維。「沒想到我們發現腫瘤組織裡有許多的放鬆纖維。既然還沒人懂健康和病變組織的纖維張力,我們必須從生理學上來理解它。」她也補充道這種肽也許可以在化療後拿來辨識和瞄準化療後殘存的病變纖維。
切除下來的腫瘤和周遭的健康組織可以在拉伸和拉緊的狀況下進行比較。舉例來說,肝癌細胞在比較硬的基質上比軟的還要容易增生且會喪失肝特徵。自然科學與腫瘤學中心之一的中心主任—賓州大學 (University of Pennsylvania) 生物物理學家丹尼斯·迪瑟 (Dennis Discher) 就說大概在 2000 年左右時研究人員就已經知道組織的軟硬度對健康程度很重要,不論原因是酗酒、病毒、肝硬化、肝纖維化或其他原因使肝臟開始變硬時,形成肝癌的機會就高。
丹麥哥本哈根大學 (University of Copenhagen in Denmark) 的癌症生物學家珍寧·埃勒爾 (Janine Erler) 說細胞外基質 (extracellular matrix) 硬化會導致癌化。她和在同校尼爾斯·波耳研究所 (Niels Bohr Institute) 任職的物理學家萊娜·奧德爾赦德 (Lene Oddershede) 將健康和癌細胞植入膠原蛋白基質 (collagen matrix) 並用光鑷 (optical tweezer) 來測量細胞硬化程度和組織密度的關係。奧德爾赦德說雖然基質密度 (matrix density) 不會改變健康的細胞,但是有侵略性的癌細胞就會隨著基質的僵硬程度變軟或變硬。埃勒爾表示:「在比較硬的微環境裡細胞會比較有侵略性。」不過目前我們還不清楚到底是基質硬化導致細胞具有侵襲性還是細胞的侵襲性造成基質硬化。
只有具侵襲性的癌細胞可以透過細孔擠進周圍的組織基質,埃勒爾的目標是要瞭解控制細胞行為的機制為何,也就是說下令細胞侵襲或無視藥物的源頭到底是什麼。埃勒爾說:「如果我們可以瞭解細胞怎麼知道周圍是僵硬環境,或許我們就可以改變細胞的反應。如此一來我們就有機會可以誤導細胞讓它們以為自己是處於柔軟的環境裡。」
卡斯和他在萊比錫的團隊觀查從乳房癌和子宮頸癌病患切下的腫瘤塊。他們發現有些區塊超過一半是不會移動的球狀細胞,而這些區塊間會有液態區讓這些細胞流到腫瘤表面並離開,就像膠質的堵塞—非堵塞轉變 (jamming-unjamming transition)。他說:「細胞可以透過形狀改變影響成為堵塞或非堵塞的狀態。換句話說,這是集體行為造成的現象,而不是單一細胞能夠控制地。」 (可參閱 Physics Today 2019 年二月號第 38 頁由 Robert Evans、Daan Frenkel 和 Marjolein Dijkstra 的文章及 2010 年十月號第 64 頁 Jasna Brujic 的文章。) 卡斯又補充道,病理學研究認為許多球形細胞的腫瘤做的預後比較精準,而有細長的細胞就有可能有轉移的情形。
殺人於無形的癌細胞轉移
一般來說,病人必須在癌細胞還沒轉移之前,就把原發性腫瘤移除才有辦法痊癒。即便如此,癌細胞還是有可能已經默默地散布出去,且造成未來復發的可能性。對普林斯頓大學 (Princeton University) 的物理學家羅伯特·奧斯丁 (Robert Austin) 來說,最迫切的問題是瞭解癌症如何轉移。「百分之九十的癌症死亡案例都是因為癌症轉移造成的」,他說:「這才是關鍵。」 (請參閱 Physics Today 2014 年二月號第 26 頁由 Chwee Teck Lim 和 Dave Hoon 所寫的文章。)
腫瘤是個高度嚴苛的環境:酸性、缺氧、養分也不足。奧斯丁的團隊將細胞放在微製造技術製成的矽基質上改變各種不同環境條件,如藥的分佈、液體的流向等,紀錄細胞的遷移過程。他說,他們將轉移細胞系混合在一起希望「越有普適性越好」。
這些在這種最嚴酷的環境下生存下來的細胞會成為多倍體 (polyploid)—他們會吞噬其他細胞並擁有多種不同細胞種類的染色體 (請見圖四)。「這已經不是單純的前列腺、骨髓或乳房癌細胞了」,奧斯丁說,這種混合方式其實是個「讓癌細胞有更多方處理難題的方法」的一種生存策略。他建議的一個新治療方法就是把藥物瞄準有多倍體核的細胞和核變成多倍體的過程。

圖四、這個轉移的前列腺癌細胞有超過三十種的染色體,是綜合了吞食異質細胞核和暴露在化療藥物下類積的成果。這些紅色點是細胞核裡被螢光標記的蛋白質。
范德比大學 (Vanderbilt University) 生醫工程系的辛西婭·萊因哈特金 (Cynthia Reinhart-King) 也使用了人造系統來研究癌症。她說:「我們可以將膠原蛋白製造成類似腫瘤膠原蛋白,也可以調整細孔和膠原蛋白的纖維大小。」有了這樣的系統,她的團隊可以試著找出細胞如何沿著纖維遷移和為什麼組織密度是乳癌的預後指標之類的問題。「我們的系統可以客製化成能研究有侵襲性細胞、組織結構角色和造成細胞遷移及成長機制是什麼的環境,也可以觀測單一和集體細胞的行為。」
萊因哈特金說物理學家和工程師最大的貢獻就是證明了疾病惡化並不是只有細胞本身有貢獻,她說:「我們認識到組織的結構、硬度、孔隙率和液體分佈都會對癌症的惡化有不小的影響。」。研究人員更進一步地發現微環境的狀況可以使正常細胞表現得像癌細胞、也可以讓癌細胞表現得像正常細胞。
萊因哈特金表示,轉移則是牽扯到領導者和追隨者 (leader-follower) 行為,其中有些細胞會帶領細胞離開原發性腫瘤。他和其他研究人員發現細胞的能量決定了誰帶路,而當帶路的細胞能量不夠時,其他的就會取而代之。不過一開始怎麼決定誰是領導者、誰是追隨者的機制還是待解之謎。除此之外還有個問題:如果一個原發性腫瘤每天可以散出上千個細胞,為什麼轉移器官相對起來這麼少?
預後的未來
美國東北大學 (Northeastern University) 的理論學家赫伯特·李維 (Herbert Levine) 分析癌細胞發出的信號以及其決策。(請參閱 Physics Today 2014年二月號第31頁 Jané Kondev 的文章。) 是什麼機制使細胞發出特別的信號?他們怎麼決定要遷移?李維舉了細胞骨架波形蛋白 (cytoskeletal protein vimentin) 為例,這種蛋白質只存在會遷徙的細胞裡,而當癌細胞開始可以運動時這種蛋白也會有可偵測量濃度改變,也就有可能是代表轉移的象徵。他考慮先從非常有限的變量開始建構動力學模型,然後根據癌症生物學家的建議加入更多的變量。他說:「我們想要瞭解各種參數跟細胞決定的關聯性。」不過這些結果其實算「模糊」,因為這並不是確切答案;不過好事情是這些結果可以被推廣到很多細胞系。
擔任西奈山計算免疫學中心 (Center for Computational Immunology at Mount Sinai) 主任的理論物理學家班傑明·格林鮑姆 (Benjamin Greenbaum) 專門研究免疫力驅動的腫瘤演化,和腫瘤對於開啟或壓抑身體免疫系統的抗癌療程反應。譬如說,為什麼免疫治療對於一部分的黑色素瘤 (melanoma) 轉移病患無效,但對其他人卻可以把疾病去除?他也同時是個由「對抗癌症 (Stand Up To Cancer)」 慈善機構所資助的跨領域團隊裡的一員,負責研究為什麼有一小部份病人可以在罹患胰臟癌之後依然活非常久的時間。他和同事們建立了一個腫瘤演化的動力學模型,也比較了一些如突變造成這類可以被免疫系統辨識之腫瘤分子的變化,嘗試找到無反應病患的治療方法。(去年的諾貝爾生理醫學獎就是因為「發現以抑制負性免疫調節法治療癌症」頒給詹姆斯·艾利森 (James P. Allison) 和本庶佑。)
加州大學爾灣分校 (University of California, Irvine) 的理論物理學家克萊爾·余 (Clare Yu) 用統計方法分析三陰性乳癌 (triple-negative breast cancer,一種有侵襲性且荷爾蒙無關的癌症) 的免疫治療法效力,可以從病人體內免疫細胞的密度和分佈,評估病人對免疫治療的成效及復發的機率。她說:「我們有大約 70% 的準確率預測五年內是否會復發。」
余也對腫瘤出現位置的機制很有興趣。譬如有超過一半的乳癌都是在腋下出現、肺癌從上葉開始出現的比下葉出現的多兩倍、大腸癌則是偏好出現在大腸前半段。余說:「這不是隨機的,而是空間位置的問題,這是種物理性質。」他喜歡這個問題因為「這看不出來能不能用信號通路 (signaling pathways) 解釋,也就意謂著有些信號級毒素之外的東西需要放入考量。」
普林斯頓大學的奧斯丁也用理論方法估計和預測癌症的行為。他說結締組織裡癌細胞和非癌細胞之間的作用可以用非線性耦合偏微分方程描述。「這是種博奕理論。你可以嘗試預知未來、預測癌如何演化。」他說轉移目前還沒辦法被事先預料,但這類的計算可以拿來預估結果並避免過度治療。
在比利時和澳洲工作的病理學家羅伯托·薩爾加多 (Roberto Salgado) 說癌組織 (cancer tissue) 裡看得到的特徵遠比肉眼可見的更多。他結合了機器學習和空間基因組學 (spatial genomics,DNA 和 RNA 的位置和組織功能與基因訊息相關的基因組學) 的碎形分析 (fractal analysis) 方法,因為細胞核的形狀、染色質 (chromatin) 密度、癌細胞生長形式和血管樣式都可以當作病理學家用來區別有侵襲性和較沒侵襲性癌的變數。「機器學習正好可以與病理學家互補,」薩爾加多說,「我想我們需要解密更多的癌症結構複雜性,也就是癌症生態學背後的奧秘。如果我們做完發現癌的空間結構與基因組學一致,那我們就成功的幫我們的病人取得更進一步的發展。」
其實對癌症研究有良好進展的關鍵之一是如何增進生物學家、臨床醫師、病理學家和物理相關科學家之間的溝通。因此去年紀念斯隆凱特琳癌症中心 (Memorial Sloan Kettering Cancer Center) 的賴瑞·諾頓 (Larry Norton) ,和同事們開辦了私人贊助的數學腫瘤學提案 (Mathematical Oncology Initiative) 嘗試建造大家的共通語言且希望能夠用數學幫助癌症研究。
本文感謝Physics Today (American Institute of Physics) 同意物理雙月刊進行中文翻譯並授權刊登。原文刊登並收錄於Physics Today, August 2019雜誌內(Physics Today 72, 6, 26 (2019); https://doi.org/10.1063/PT.3.4223);原文作者:Toni Fefer。中文編譯:朱家誼 博士,國立中興大學物理系 博士後。
Physics Bimonthly (The Physics Society of Taiwan) appreciates that Physics Today (American Institute of Physics) authorizes Physics Bimonthly to translate and reprint in Mandarin. The article is contributed by Toni Feder, and are published on Physics Today 72, 6, 26 (2019); https://doi.org/10.1063/PT.3.4223). The article in Mandarin is translated and edited by Dr. Chia-Yi Ju, working on Department of Physics, National Chung Hsing University.