
1910年諾貝爾物理獎:約翰內斯・范德華
- 發現自然之美:諾貝爾物理獎
- 撰文者:余海峯 博士
- 發文日期:2017-02-01
- 點閱次數:1012
是什麼使氣體凝聚成液體?氣體與液體的分別,一直是許多科學家希望理解的問題。1910年諾貝爾物理奬得主約翰內斯・范德華(Johannes van der Waals)就用數學描述了兩態之間的互換原理。


我們知道在一般環境條件下,可以用理想氣體方程(ideal gas law)描述氣體的壓力、體積、溫度、份子數量的關係。理想氣體方程是伯諾瓦・保羅・埃米爾・克拉佩龍(Benoît Paul Émile Clapeyron)在1834年從三大氣體定律歸納出來的:壓力與體積成反比(Boyle’s law)、體積與溫度成正比(Charles’s law)、體積與粒子數目成正比(Avogadro’s law)。這種熱力學方程式,統稱為物態方程(equation of state)。
然而,科學家發現理想氣體方程在高壓力之下並不適用。當我們發現舊有理論在非一般條件下變得不適用,就是需要新理論的時候了。范德華在博士班時已經對這個問題十分感興趣。1873年,他在博士畢業論文《論氣態與液態之連續性》(Over de Continuiteit van den Gas- en Vloeistoftoestand)裡導出了一條能應用於氣體與液體的物態方程。
這條方程式就是著名的范德華方程(van der Waals equation)。簡單來說,范德華方程就是理想氣體方程的改良版本。范德華認為在高壓力下理想氣體方程失效的原因是其忽略了氣體份子本身的體積以及份子之間的吸引力。
我們熟悉的理想氣體方程是 PV=nRT,其中 P 是氣壓、V 是體積、n 是份子數量(以摩爾mole為單位)、T 是溫度,而 R 就是理想氣體常數(ideal gas constant)。范德華導出的改良方程為
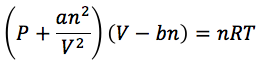
其中a代表份子之間的吸引力、b代表份子所佔的體積。式中左邊第一個括號代表份子之間的壓力並不單止其互相碰撞的壓力P,還要加上其相互吸引力;第二個括號則表示其體積等於容器的總體積V減去份子本身的體積。
當壓力上升,氣體就會變成液體。然而,如果該氣體的溫度高於臨界溫度時,就會保持在氣態。范德華發現,如果知道物質的臨界溫度,單單以比例就可以完全描述該物質的氣態和液態。

[壁虎之所以能在平滑的垂直面上爬行,是因為牠們的足上佈滿蛋白質β-keratin,能與垂直面產生強大的范德華力。Image courtesy of Lpm/Wikimedia Commons]
現在,我們把這種份子之間的吸引力稱為范德華力(van der Waals force)。范德華當年並不知道為什麼份子之間存在吸引力。這關乎原子結構,簡單的解釋是各個份子的電子會互相排斥,因此一部分原子核就會「暴露」出來,與電子相吸引。我們在之後介紹著名的尼爾斯・波耳(Niels Bohr)時,會繼續討論原子結構。