
LED、邏輯匣、大腸桿菌-合成生物學與基因電路設計
- APS News
- 撰文者:原文作者:Sophia Chen,中文編譯:林祉均
- 發文日期:2019-05-22
- 點閱次數:2022
在2019美國物理學會三月會議的一場發表會中,Chris Voigt—麻省理工學院合成生物學(synthetic biology)的研究人員—切換到下一張投影片,投影片上是傳統計算機螢幕上會看到的七段數字顯示器:七個可發光的線段排成一個8字,由程式控制,可以隨意顯示出零到九的數字;只不過Voigt的七段顯示器跟我們熟悉的計算機螢幕上的有些不同:它的組成元件不是LED,而是接收特定化學物質時會發光的細菌。
合成生物學(synthetic biology)是什麼呢?
“ 廣泛來說,就是「將工程學原理運用在生物領域」,來自物理背景的康乃爾大學研究生David Specht這麼說。生物細胞內的DNA就像是電腦內的軟體,負責主宰外部的「硬體」如何運行;合成生物學便是一門操縱細胞內部「軟體」的學問。”
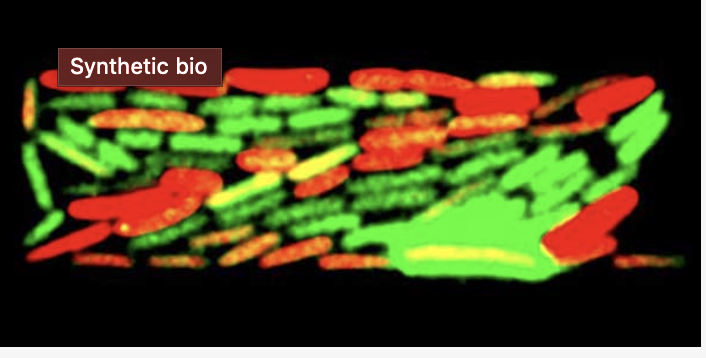
Guillaume Lambert 研究人員示範用DNA電路控制大腸桿菌中發出螢光。
法國波爾多大學的Jean-Christophe Baret更明確的指出:合成生物學家想要做的,是利用細胞轉化化學物質的能力,達成特殊的目的。像是讓經過基因改造的酵母細胞產生有商業價值的特殊化合物,製成香水或是生質燃料。這方面的應用已經可以在市面上看到,算是合成生物學中相對成熟的產業應用。
但其實我們對於酵母細胞的控制技術並不好。
Specht說:「酵母細胞大量產出化合物,最後根本被自己的廢棄物淹沒」。合成生物研究人員想要做到的,不僅僅是這種對酵母細胞的初步操控;他們想要發展出足夠成熟的技術,能掌控數百,甚至數千組基因,藉此駕馭不同種類的各種細胞。最終極的目標:任意設計並生產各種功能的細胞,來執行不同任務,就像是設計電路一樣輕鬆。
為了達成這個遠大的目標,研究人員首先要做的是重新改造特定的DNA片段,讓細胞能模仿電子元件的邏輯運算功能。當遭遇不同的化學物質輸入,細胞會根據DNA的指令啟動不同反應,像是成長、分裂、或產出特定蛋白質。把設計過的DNA片段放入細胞中,就像是在程式碼中加入指令,讓研究人員能控制細胞功能。
在這個階段,Specht已經成功設計出一串DNA,當植入大腸桿菌細胞便能表現出像是NOT邏輯匣的行為。傳統電腦中的NOT邏輯匣收到輸入1則會輸出0;反之則輸出1。在細胞的例子中,如果它察覺到周圍存在特定的化學分子,便會停止產生某種蛋白質;如果周圍沒有該化學分子,細胞則開始產生蛋白質。
以往就有一些研究團隊展示過類似的NOT細胞,不過這些嘗試往往有個問題:當許多NOT細胞被放在一起,他們彼此會互相影響,Specht稱之為「串擾(crosstalk)」,也就是相近的電路之間信號互相干擾的現象。細胞中的不同部位常常會有意想不到的耦合關聯,所以這種干擾是合成生物學需要解決的難題。Specht發展出了一套系統性的方法,可以有效判斷兩個NOT細胞是否會互相影響,也已經在128種不同的NOT細胞上測試。
另一方面,Specht的研究夥伴正準備幫大腸桿菌細胞加上全新功能。康乃爾大學的Yasu Xu設計的DNA可以處在「開」或「關」的狀態。當細胞處在特定的環境條件,這段基因碼的開關狀態便會命令細胞開啟或停止特定蛋白質的產出。Xu眼下的目標是讓這種開關只對特定的化合物濃度有反應,也就讓細胞可以簡單地執行類似感測器的功能。這樣的開關機制也許能扮演電腦中位元的角色,將兩種狀態分別當作1跟0,達成儲存資料的目的。
合成生物學在十年之前才剛起步,那時研究人員必須要花費無數個小時才能設計出一段所謂的「基因電路」。為了加速設計的過程,向更複雜的電路邁進,Voigt的研究團隊發展出一個稱為CELLO的軟體平台。CELLO的功能有點像是協助工程師設計電路的電腦軟體。它能將程式碼整理成個別邏輯匣的組合,並繪製成圖;最後再寫出各個邏輯匣功能所對應到的DNA序列。研究人員只要將整個設計交給外部公司,讓他們進行合成DNA的工作就可以了。
除此之外,研究人員也正著手改造細胞產生能量的代謝反應,期待能透過操控這類反應,改善細胞產生蛋白質的速度。這類的改造細胞不僅有廣泛的產業應用,也可能對基礎研究帶來重大突破。像是Baret提到的:可以拿來測試關於生命起源的各種假說。
一般的細胞會消耗葡萄糖,藉此把NAD+ 轉化成 NADH。 用Baret的話來說:「這個反應將葡萄糖的化學能轉換成細胞可以運用的能量,可以說是細胞仰賴的能量幫浦」,因此這個反應也是Baret團隊的研究重點。他們將小水滴包覆在油脂內,藉此簡單地模擬一個活體細胞。在小水滴內注入葡萄糖、NADH和NAD+ 之後,研究團隊用雷射監測水滴內各物質的濃度。結果和真實細胞中情況一樣:NAD+ 和NADH的濃度維持在一個穩定的比值。在未來的實驗中,Baret希望能將葡萄糖放在水滴外,讓「細胞」自己去攝取反應所需的原料。
不過生物電路工程目前仍然需要克服幾個嚴峻的挑戰:細胞維生需要消耗一定的能量,如果能關掉這些消耗反應,或許能讓化學物質的產出更有效率,不過這種做法的可行性至今尚未確知。另外,細胞必須要能夠在浮動的環境條件下工作,同時克服不同基因間的耦合影響。研究人員在改動細胞內部時還要小心不要破壞細胞的其他重要功能。因此,儘管目前的研究結果展現十足的潛力,大規模生產各式生物電路的願景可能還要再等幾年。
本文感謝APS NEWS(美國物理學會)同意以中文形式翻譯轉載,原文刊登於APS NEWS網站:https://www.aps.org/publications/apsnews/201904/rewire.cfm?fbclid=IwAR0oZmtaAo36Tb3ujVW3pJCE--BfPQr1wCkQmiImAfxYmIWzmvkMO6oD_b0