
烏賊球狀水晶體中的漸進式折射率是怎麼變出來的
- Physics Today
- 撰文者:原文作者:Sung Chang。中文譯稿:林中一教授
- 發文日期:2017-11-28
- 點閱次數:934
深海是一個昏暗的世界,照到海面下300公尺深的陽光量大約只是照在海面的萬分之一。烏賊的眼睛為了適應那些低光的深海狀況,已演化形成球形水晶體。從透鏡光學的角度來看,在固定透鏡半徑之下,球形透鏡的焦距是最短的;這使得相對於虹膜上成像的大小,球形透鏡最佳化了眼睛開口的尺寸。不像人類的橢圓形水晶體是透過改變眼球形狀來調整焦距,烏賊的水晶體焦距是固定的。烏賊是藉著移動水晶體來聚焦。然而球狀水晶體會產生球面像差,而且會隨著聚焦能力的增強,產生的像差會更形嚴重。
1854年的時候馬克斯威(James Clerk Maxwell)理論證明了,如果折射率能夠以到透鏡中心距離的二次函數做變化,則球形透鏡可以避免產生球面像差。然而「演化」比馬克斯威早了好幾百萬年就發現這回事了。烏賊,就像在圖1看到的那一隻,還有一些魚類,早就已經在使用漸進折射率式的水晶體。藉著構成水晶體的S-晶狀體蛋白密度的徑向變化—中心的密度高而邊緣的密度低—形成烏賊眼球的折射率梯度。
美國賓州大學(University of Pennsylvania)的史維妮(Alison Sweeney)與她的同僚們報告找到了已經為一個困惑大家已久的生物難題的解答;這個難題就是:『烏賊眼睛的水晶體是如何建立其中的蛋白質梯度以保持均勻的透明度1。』團隊發現烏賊水晶體裡的細胞會隨著其徑向位置,將大約40種差異極細微S-晶狀體蛋白變體以不同的比例混合。所有的混合物都形成凝膠—或至少形成蛋白質的空間網絡—但其密度會隨著位置不同而變化。凝膠化防止了蛋白質聚集成不透明的結塊,也抑制了會造成視覺失真的局部密度擾動。
演化形成的自組裝
烏賊水晶體裡的S-晶狀體蛋白的變體都有一些共同性,就是都有一個近乎球形的本體加上兩支彈性的兔耳形的圈圈,這些環的長度不一,從三個氨基酸到幾百個氨基酸都有,而且氨基酸排列的順序也很不同。
史維妮在2000年中期還在讀研究所的時候,就從演化生物的觀點著手處理過烏賊水晶體的問題。她早就知道許多不同的S-晶狀體蛋白都是一個叫做「麩氨基硫轉移酵素」(glutathione S-transferase)的演化親戚,那個酵素具有中和有毒分子的功能。她解釋道:「演化是有助於削減一些東西的。」特定的壓力可以刪除許多突變的拷貝,但是史維妮的研究顯示,自然選擇的結果卻保留了所有那些S-晶狀體蛋白的變體。這個發現指出,結構的變動可能具備若干的功用2。
依據史維妮的觀點,這裡的物理亮點在於「自組裝」。當烏賊的眼睛完全成形時,水晶體細胞會將其細胞核和核酸醣小體排出,留下的S-晶狀體蛋白形成超過95%的非水質量。但是,神奇的事情發生了,這些蛋白質在細胞內透過自組裝產生了適當的密度,使得水晶體的折射率產生梯度的變化(自邊緣的1.3(相當接近海水的折射率)到中心的1.6)。在水晶體的核心,這些蛋白質擠壓得是如此緊實,把細胞中的水份完全的擠出。而在外緣,水晶體的密度則接近水的密度。
當史維妮在2012年到了賓州大學的時候,她決定挑戰水晶體的物理。博士後蔡晶(Jing Cai)回想起她的第一個任務就是去捉烏賊。捉到之後,蔡就將烏賊的水晶體切成四個環狀層(如圖1中的嵌入圖所示)。

圖1. 烏賊眼睛特寫。為了最佳化眼睛的折光能力而不必忍受球面像差,烏賊演化出了一個特殊的球形水晶體。水晶體裡的蛋白質密度具有徑向梯度,也就使得水晶體的折射率在徑向產生梯度。嵌入圖所示為連續蛋白質密度梯度的示意圖,畫在40%、60%、和80%相對半徑的圓形虛線就是實驗中將水晶體切片為球形層的位置。© 2014 MBARI
備妥了水晶體之後,史維妮與同僚們就進行RNA(核糖核酸)排序,而且發現了53種獨特mRNA。團隊無法確定那些mRNA中有多少會變成獨特的蛋白質。然而,電泳分析顯示有各種不同分子量的S-晶狀體蛋白出現在各環狀層中(見圖2)。那些分子量與RNA排序所預期的緊密的吻合。
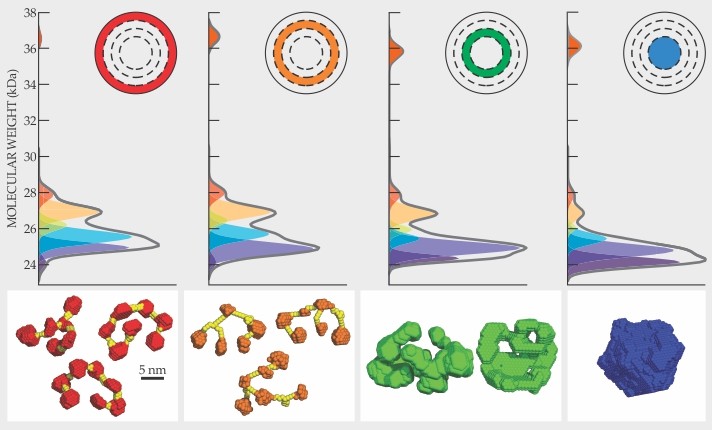
圖2. 在烏賊眼睛的水晶體內,蛋白質的變形依著沿徑向變化的比例結合。灰色曲線所示為在嵌入圖中標示之水晶體的四個環狀層測量得之蛋白質相對分子量分佈。彩色尖峰為計入由RNA排序所訂出之蛋白質變形分子量的高斯擬合(Gaussian fit)分量。下方圖版所示為由各個環狀層的小角度x-光散射數據所導出之結構模型。在水晶體外緣部分,蛋白質形成鬆散的鍊,其中每個蛋白質連結了兩個,或偶而三個其他的蛋白質。在水晶體核心部分,蛋白質緊密的堆積,每個蛋白質會與四個或更多其他的蛋白質相連結。(改寫自參考文獻1)
參考文獻
研究者們進行了小角度X-光散射(SAXS)的量測來觀察有那幾種蛋白質的結構會出現。史維妮的團隊希望在SAXS實驗中能觀察到那些能防止蛋白質形成不透明團塊的相斥作用的證據。單純的相斥作用會造成在低散射角的X-光強度降低。但是研究者觀察到相反的結果,散射X-光的強度隨著散射角的增大而連續降低—這是當質點相接觸時因吸引作用而形成更大等效質點的表徵。
皮蛋與凝膠
在研究團隊奮力的要瞭解吸引作用是如何發生的時候,英國劍橋大學(Cambridge University) 的艾瑟(Erika Eiser)正好在賓州大學訪問。艾瑟當時研究過皮蛋裡蛋白的轉變。皮蛋是中國傳統佳餚,製作的方式是將生蛋埋在鹼性泥土中幾個星期到幾個月的時間而成。在鹼性泥土中蛋黃會變成墨綠色而蛋白則轉變成棕色的透明凝膠。
艾瑟注意到史維妮的烏賊水晶體實驗觀察和她在皮蛋中發現的吸引作用的相似性。艾瑟運用「補丁膠狀體理論」(patchy colloid theory)來解釋吸引作用;所以她建議史維妮去看一看一篇羅馬大學的賽奧提諾團隊(Francesco Sciortino’s group at the University of Rome) 有關補丁膠狀體理論的論文3。蔡晶提到:「史維妮到她的面前對她說,『我們來試一試這些補丁顆粒吧!』結果完全行得通。」
補丁膠狀體理論用黏性的表面補丁來處理球形膠狀體顆粒間的交互作用。顆粒的表面若是有較大片或更多數目的補丁就能與更多的相鄰顆粒相作用,反之補丁越小或越少,能作用的相鄰顆粒就越少。這個理論用在烏賊的水晶體,就是將個別S-晶狀體蛋白的球形本體當作膠狀體顆粒,而它的那兩隻兔耳狀圈圈則視為黏性的補丁。
在水晶體的外緣部分,有長圈圈的顆粒居主導地位;顆粒之間易於產生圈圈與圈圈之間的連結。分子動力學(Molecular dynamics)模擬顯示相鄰的蛋白質的圈圈之間是透過氫鍵相依附。這種狀況可以用有兩塊補丁的顆粒來代表。由外緣向內移動,兔耳狀圈圈開始變短,而且偶而會有三個蛋白質各出一支圈圈結在一起而形成分枝鍊,這個就可以對應有三個補丁的顆粒。當圈圈長度更短時,圈圈本身就可以連結到其他蛋白質的本體而形成更緊密的分枝網路;這種情形就可看為有超過三個補丁的顆粒。在水晶體核心部分,蛋白質將體積完全填滿,個別的蛋白質可能和四個或更多的蛋白質黏在一起。
補丁理論預測那些補丁膠狀體顆粒即使在低顆粒濃度之下還是能自然連結成鍊,這個結論解釋了賓州大學的研究者所遇到的一個實驗困難。一般來說,這一類研究的典型作法是,先把蛋白質稀釋並將不同類蛋白質分離,再對溶液中分離出的蛋白質做散射實驗以觀測它們的散射特性。但是這種作法對S-晶狀體蛋白失效。史維妮解釋說道:「不論我們怎麼稀釋烏賊水晶體中的蛋白質,但是它們總是成鍊。」
賓州大學團隊的工作可能隱藏了一個缺失,就是她們在分析X-光數據使用了一個描述個別蛋白質散射特性的單一平均後的形狀因子(form factor),但是實驗樣品卻含有許多S-晶狀體蛋白的變體,每一個都有它自己的形狀因子。然而史維妮和蔡晶堅持各個變形的形狀因子之間的變化不大,這使得在測試不同的個體時不至於會改變她們的結論。
史維妮團隊推測,當水晶體生長時雖然有新的細胞產生,然而基因會讓S-晶狀體蛋白的變體保持特定的比例。依據補丁理論,當濃度超過某個門檻後之後補丁顆粒就形成凝膠,該濃度的門檻則是由組成顆粒上的補丁數所決定的。當凝膠化發生後,mRNA就不再能在細胞裡四處移動了,這也就終止了蛋白質的製造。在水晶體的外緣部分,佔主導地位的長圈圈蛋白質導致平均每一個顆粒有兩個補丁。在核心部分,佔多數的短圈圈蛋白質意謂著一個顆粒上有更多的補丁。而補丁數目越大,蛋白質的堆積就越緊密。隨著水晶體內蛋白質密度的徑向變化,所產生的就是折射率的梯度。
史維妮指出,烏賊的水晶體看來是第一個能夠顯現出由補丁膠狀體理論所預測特性的自然系統。她問道:「我們能從那個自然系統學到些甚麼呢?」
參考資料
1. J. Cai et al., Science 357, 564 (2017).
2. A. Sweeney et al., J. R. Soc. Interface 4, 685 (2007).
3. E. Bianchi et al., Phys. Rev. Lett. 97, 168301 (2006).
本文感謝Physics Today (American Institute of Physics) 同意物理雙月刊進行中文翻譯並授權刊登。原文刊登並收錄於Physics Today, November 2017 雜誌內(Physics Today 70, 10, 26 (2017); https://doi.org/10.1063/PT.3.3718
);原文作者:Sung Chang。中文譯稿:林中一教授,國立中興大學物理系。
Physics Bimonthly (The Physics Society of Taiwan) appreciates that Physics Today (American Institute of Physics) authorizes Physics Bimonthly to translate and reprint in Mandarin. The article is contributed by Sung Chang, and are published on Physics Today 70, 10, 26 (2017); https://doi.org/10.1063/PT.3.3718). The article in Mandarin is translated by Prof. Chung-Yi Lin, working on Department of Physics, National Chung Hsing University.