
光鑷在生物系統之應用與重要性
- 物理專文
- 撰文者:張宜仁、張博睿
- 發文日期:2019-03-05
- 點閱次數:2963
提到光鑷 (optical tweezers),許多人第一個聯想到的也許會是影集「星艦迷航記」(Star Trek) 中用來移動各式物體甚至大到一艘小太空船的牽引光束。在現實中,要利用光來操控物體也許有點天方夜譚,但在顯微鏡下的世界,經由光與物質的散射與電磁交互作用下,藉由其間的微小作用力,確實可以實現這樣的操作。今年的諾貝爾物理獎得主之一Arthur Ashkin 被譽為光鑷之父 1他最一開始主要著重於輻射力與光壓的研究,接著發現了藉由光基本的梯度與散射力,即一束光可將微小粒子推向光強度較強的位置,而這也慢慢形成了光鑷的理論基礎。從光的粒子性我們不難聯想到光子會產生光壓將微小粒子推向光行進的方向。在 1960 年代雷射發明之後, 1970 年 Arthur Ashkin 便成功觀察到微米 ( μm) 等級的粒子可被光加速,或是利用兩道對向的光束將微粒子穩定的捕捉在三度空間 2。
1971 年時他利用光與重力的平衡,也可成功的捕捉 20 微米的粒子 3。重要的是,1986 年Arthur Ashkin 發現,利用一道強烈聚焦的光,則介電質微粒子 (dielectric particles) 不會因為光壓的關係被光推走,反而是被光拉至聚焦點 4。這項發現不僅奠定了單光束光鑷的基礎,也大大的展開了光鑷在生物系統的應用。因為,許多顯微鏡使用高數值孔徑 (numericalaperture, NA) 的物鏡,非常便於形成光鑷需要的條件,此外,許多生物物體的大小,正好就是在微米的範圍,也是非常適合被光鑷捕捉。光鑷的捕捉力與雷射的功率成正比,但即便用到高功率的雷射,一般來說,光鑷的最大捕捉力量就是約 100 皮牛頓 (piconewton,10-12 N) 的範圍。這個力量雖然不大,但足以用來量測許多生物世界中的力。譬如驅動蛋白可以輸出的力、許多分子馬達產生的力、細胞與細胞間的黏附力或一些細胞分子間的作用力等等,都屬於光鑷可以量測的範圍。
 光鑷在生物系統上的捕捉與操縱
光鑷在生物系統上的捕捉與操縱
光鑷最一開始被廣泛的應用於細胞骨架馬達蛋白的研究上。這些細胞骨架馬達蛋白會沿著細胞骨架運輸有機質,與染色體分裂及細胞間訊號傳遞都息息相關。然而,若要觀察kinesin 這種驅動蛋白在微管 (microtubule) 上的物理特性,科學家一開始只能被動地等待在microtubule 上是否有 kinesin 的出現。此時,光鑷恰好就扮演了一個非常適合的工具。因為,我們可以將 kinesin 黏附於一個直徑為 1 微米的聚苯乙烯小球 (polystyrene bead) 上,並利用光鑷捕捉小球並把它放在微管,甚至是微管上特定的位置。如此,我們化被動為主動,可以決定想觀察的時間,位置等等。也因此,許多 kinesin 的物理特性可以被量測出。譬如每走一步大約是 8 奈米,它的最高速度在細胞外約 0.8 μm / s ,在細胞內甚至可達2 μm / s 等等 5。 當然,我們也可以利用光鑷將 DNA 打結、捕捉細菌並藉此量測其物理特性 6,7、甚至結合微流道來做細胞或微粒子的篩選 8–10。
 多光點光鑷與全像光鑷
多光點光鑷與全像光鑷
前面提到利用光鑷捕捉及操控顯微鏡下的微小物體,自然地,科學家也就會想到是否可以同時產生多光點光鑷。首先,我們可以將一道雷射光一分為二,或是利用多台雷射在同一台顯微鏡下形成雙光點或多光點光鑷。事實上,當我們擁有雙光點光鑷時就已經可以得到許多應用,譬如可以量測紅血球的形變 11、黏彈性係數 (viscoelasticity) 12、甚至是直接量測兩個紅血球之間黏附力的大小等等 13。而這些研究,讓我們可以從物理特性的角度去了解許多紅血球相關的疾病 13,並幫助對這些疾病的治療。
當然,相較於引入多道光束,若我們可以利用一道雷射光,產生多於雙光點的光鑷,在系統的安排與應用上就會更加簡潔與彈性。於是,首先被提出來的方式,便是利用聲光調變器高速改變光束行進方向的特性,結合共軛焦顯微鏡相同的掃描概念,快速地將雷射光的焦點在多個位置上輪流停滯 14。利用這樣分享光束停留的時間,也可以等效地產生多個捕捉的位點。但是,這樣的方式也有明顯的缺點,就是由於在捕捉位點上的光場並不是持續存在,且存在的時間比例也會隨位點增加而減少,也就無法穩定地捕捉,也較不適用於對樣品快速響應的觀察 ( 圖一 A)。
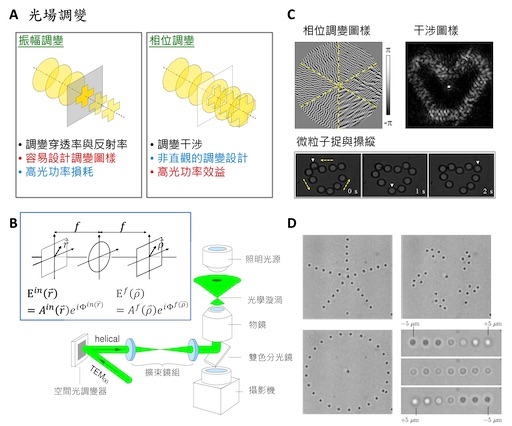
圖一:多光點與全像光鑷 。A. 利用強度與相位調變光場的方式與優缺點:利用強度調變的光罩圖案設計比較直覺也簡單,但缺點是會浪費較多的光能量,利用相位調變的方式相位光罩圖案的設計雖然比較不直覺,但可以保留比較多的光能量。B. 全像光鑷的理論概念及系統架設圖 15,19。C. 全像光鑷在空間光調變器上的圖案與光鑷在焦平面上的分布的一例,下圖中為多個微粒子被這樣的光鑷捕捉並操控 17。D. 全像光鑷可同時捕捉多個微粒子,可以藉由電腦輸入各種圖案,並可做三維的操控( 右下角 )。如右下角圖所示,多顆微粒子被捕捉及操控在不同的平面 ( 縱軸位置 )18
為了突破這樣的限制,全像光鑷(holographic optical tweezers) 的概念便被提出來了 ( 圖一 )。從本質上來說,光鑷的捕捉力其實來自於光場的強弱變化,這也是這個力量被稱為是梯度力的原因。只要能夠改變雷射光場的空間分布,便可以達成更多樣的捕捉方式。因此,利用相位光罩或是空間光調變器 (spatial light modulator) 對雷射的光場相位進行調變,進而產生多光點光鑷的研究於焉產生 15–19。簡單的說,當雷射光的橫向光場的相位,受到全像光罩或是空間光調變器的調變,再經過光學系統後,便會彼此干涉,而可創造出各種強度變化的雷射光場,也就形成不同形式的光鑷 ( 圖一 B)。而這種利用相位調變與干涉的方法,相對直接用光罩去遮蓋或分光,不僅可以減少光能量在整個系統中的損失,也可以彈性的創造出更複雜的光場形貌 ( 圖一 A)。其中,空間光調變器可以利用電腦直接產生圖形,於是,我們可以將空間光調變器放置於顯微鏡物鏡後焦平面的共軛平面上 ( 圖一 B),即時改變顯示在空間光調變器上的圖形,則可以即時改變多光點光鑷的位置,甚至可以達到三維的調控 ( 圖一 D)16,20。這類的研究還有更多的發展,也促成了許多光學理論的發展 15,17( 圖一 C),以及光學工程上的進展。譬如可以產生線型的光鑷 21,22;或是光學漩渦(optical vortex) 這樣具備角動量光場 15,可以在不改變光場分布就可以推動捕捉粒子的光鑷等等。
 利用光鑷與光電鑷夾於篩選與分類的應用
利用光鑷與光電鑷夾於篩選與分類的應用
既然光鑷可以捕捉微粒子,甚至可以形成多光點或是其他特殊形狀的光鑷,自然地,科學家也就想要利用它與微流道,做為微粒子,甚至生物體如細胞篩選 (sorting) 的工具 (圖二 )。譬如,當微粒子因為大小或特性不同,而與光鑷的交互作用力不同時被分離、或是當有目標微粒子經過時,主動地利用影像辨識,開啟或關閉光鑷、或是利用線形或其他形狀的光鑷,使得目標微粒子被光鑷改變方向或是沿著光鑷的方向而被引導至某一個微流道而達到篩選的目的 8,22,23。除此之外,以光鑷作為篩選的方法也激發了其他利用光來篩選微粒子的方法,例如光電鑷夾 (圖二B、C)24。其原理來自於在非均勻電場中的介電質微粒子,會因為與電場而產生誘導偶極,並因誘導偶極與電場相互作用,而產生力將微粒子吸引或推開。因此,若製作一個類似三明治結構的介電泳 (Dielectrophoresis,DEP) 晶片,上下層為氧化銦錫 (ITO) 材料,中間則可以注入微粒子或設計成微流道結構。接著,再次利用空間光調變器,或是微陣列鏡片 (DMD) 產生需要的圖案,並將這樣的圖案投影到介電泳晶片上,便可以產生跟設計的圖案一樣的光電鑷夾,用以捕捉、操控、或篩選微粒子 24,25。
圖二:應用光鑷與光電鑷夾進行篩選與分類示意圖。A. 利用晶格 (optical lattice) 光鑷來分類大小不同的微粒子:當微粒子由右邊流向左邊時,2 微米的微粒子會被引導向上,而 4 微米的粒子則不受影響繼續朝左 23。B. 利用活細胞與死細胞內的離子濃度不同造成介電係數不同而被光電鑷夾分離 24。C. 利用 DMD 操控光電鑷夾主動篩選及分離微粒子 25。
光電鑷夾有幾個很大的好處,例如:它可以不需要雷射光,只需要非同調性且低能量的光,便可以進行操作。而且,其產生的電場力量遠大於光鑷的捕捉力。當然,如前面所述,這樣的設計也可以即時的改變電場的圖形,亦即達到即時的操控。
 光鑷的力量測與單粒子追蹤系統
光鑷的力量測與單粒子追蹤系統
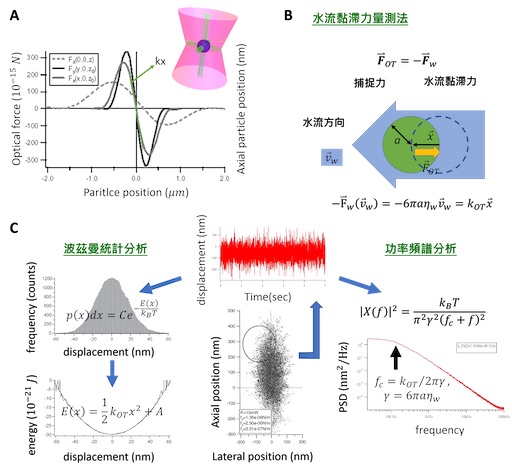
光鑷捕捉力的行為就像是一個彈簧作用力一樣,當被捕捉的微粒子越遠離捕捉平衡中心時,捕捉力越強 ( 圖三 A)。其中,捕捉力與微粒子距離捕捉中心的距離有一個光鑷彈性係數 kOT 。最簡單的光鑷捕捉力的量測莫過於是水流黏滯力量測法了。基本上,利用水流去沖刷被捕捉的微粒子,微粒子受到水的黏滯力被沖離開捕捉中心,但當離開捕捉中心越遠也會有越強的捕捉力將其拉回捕捉中心,直到兩力達到平衡。所以,若改變幾個不同的水流速度,並量測這幾個靜力平衡下時微粒子被沖離捕捉中心的位移,即可以得到黏滯力( 也就是捕捉力 ) 與微粒子位移的關係,也就求得了光鑷彈性係數 ( 圖三 B)。其現象如同方程式 (1) 所描述,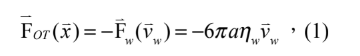
其中,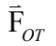 為光鑷捕捉力、
為光鑷捕捉力、 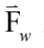 為水流黏滯力、 a 為微粒子半徑、
為水流黏滯力、 a 為微粒子半徑、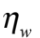 為水流黏滯係數、
為水流黏滯係數、 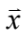 為微粒子與捕捉中心的位移、
為微粒子與捕捉中心的位移、 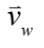 為水流速度,而
為水流速度,而
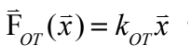
然而,若微觀來看,在水溶液中,微粒子會因與溶液碰撞,而產生熱擾動的行為與現象 ( 圖三 C)。且當微粒子越小,熱擾動的行為也就越劇烈,即便被光鑷捕捉,此一熱擾動還是存在,只是被限制在光鑷捕捉陷阱範圍中。因此除了水流黏滯力量測法,我們也可以偵測微粒子在光鑷中的熱擾動,透過波茲曼統計 (Boltzmann statistics),回推出光鑷捕捉陷阱的能量,也就可以得到光鑷彈性係數 ( 圖三 C)26。詳細來說,微粒子在一個能量井中的
各個位置出現的機率為: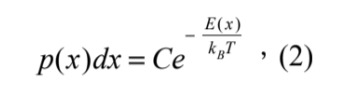
其中 p(x)dx 代表熱平衡下, E(x) 這個能量井中 dx 範圍內找到這個微粒子的機率、kB為波茲曼常數、T 為溫度 (凱氏溫標K)、C 為歸一化常數使得 ∫ p(x)dx = 1。能量井也就為:
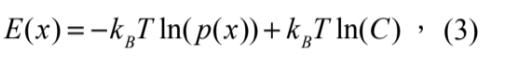
且可對比為一彈簧模型: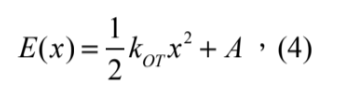
其中 kOT 為光鑷彈性係數, A 為常數。
我們也可以把微粒子在光鑷中的熱擾動行為進行功率頻譜分析 (power spectrumanalysis),量測出功率譜密度曲線的截止頻率 (cut-off frequency) 即可得到光鑷彈性係數 (圖三 C)27,28。從微觀來看,一個於溶液中被光鑷捕捉的微粒子,因其質量、尺寸大小與環境黏滯所得之雷諾數 (Reynolds number) 很小的緣故,熱擾動作用力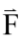 、光鑷捕捉力
、光鑷捕捉力 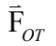 與水流黏滯力
與水流黏滯力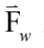 幾乎隨時是平衡的,故
幾乎隨時是平衡的,故
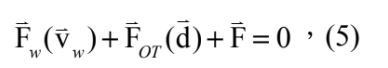
而其簡化之一維朗之萬方程式 (Langevin equation) 可表示為:
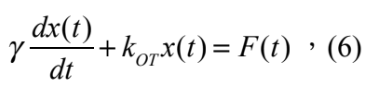
其中 γ = 6πaη w 。將式 (6) 等號兩側取傅立葉轉換則可得到:
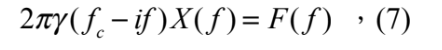
其中 F( f ) 與 X( f ) 分別為 F(t) 與 x(t) 的傅立葉轉換, F( f ) = F{F(t)}、 X( f ) = F{x(t)},而 fc = kOT / 2πγ 為截止頻率。再將式 (7) 左右兩側都取絕對值平方,也就是功率頻譜,
則可得到: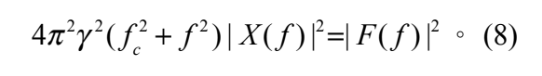
微粒子被光鑷捕捉的捕捉過程中,熱擾動相當的隨機,也就是 F(t) 在一個長時間內的平均為零 ( 相當於回到巨觀來看,( F(t) = 0 ),且其功率頻譜由愛因斯坦關係可得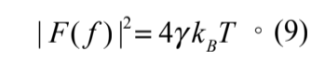
將式 (9) 代回式 (8) 則我們可以得到: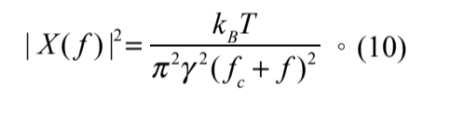
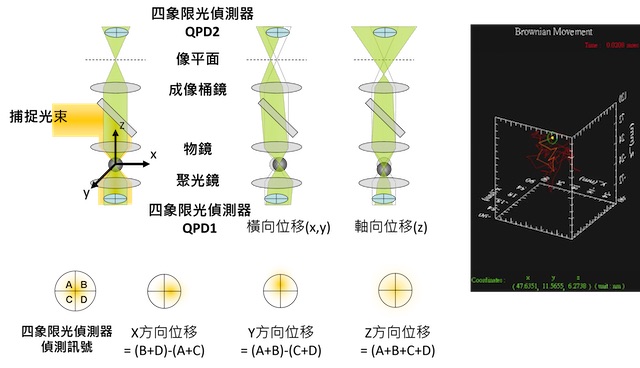
總結來說,我們觀察一被光鑷捕捉的微粒子的熱擾動現象一段時間後,利用式 (4) 線性回歸至波茲曼統計的結果,或式 (10) 線性回歸至功率頻譜分析,即可獲得光鑷彈性係數( 圖三 C)。然而為了偵測微粒子的熱擾動,直接觀察微粒子的亮視野影像並沒有辦法那麼精確。這主要是受到物鏡放大率的限制,一般而言,攝影機 (CCD Camera) 無法解析微粒子的位置達到十奈米以下的解析度。因此,可以更精確量測微粒子位移的單粒子追蹤系統(single particle tracking system) 也就被開發出來 ( 圖四 )29–31。在光鑷的領域中,我們可以量測雷射打到微粒子產生的前向或背向散射光 (forward or backward scattering light),或是與沒有被微粒子散射與散射光的互相作用的干涉光 29,31。量測的方式是將一個四象限光偵測器 (quadrant photodetector ),放置於產生光鑷的物鏡,或是另一個在原本物鏡對向的偵測物鏡的後焦平面上來偵測散射或干涉光斑 ( 圖四 )。如此,我們不僅可以偵測微粒子的位置達到只有幾個奈米 (nm) 的解析度,且可以達到 MHz 的時間解析度。為了能真正精確偵測量出微粒子的位置,有許多關於單粒子追蹤系統的細節的研究 29,30,譬如微粒子的大小與物鏡數值孔徑的組合會影響到偵測位置的線性關係與適用範圍 29。另外,藉由在系統中加入另一道偵測雷射,並調整這道雷射的聚焦光點,對於適用於偵測的微粒子尺寸大小可以更彈性,也更可以優化偵測位置的靈敏度及線性範圍 30。

利用微粒子熱擾動量測光鑷的捕捉力還有一個好處,就是它可以同時量測出光鑷三維的光彈性係數,因為光鑷本身就是一個三維的位能井,而縱向的光彈性係數很容易被忽略,且在過去利用水黏滯力量測法也是非常難辦到的。能夠獲得三維的光彈性係數,也使得應用光鑷於生物力的量測可以更精確了 31。
 應用光鑷於生物力的量測
應用光鑷於生物力的量測
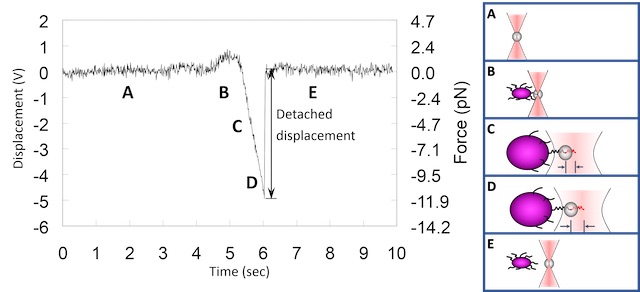
藉由前述的光鑷彈性係數量測,並量測微粒子與捕捉中心的位移,便可以獲得目前施加在微粒子上的力。結合可以簡單地在顯微鏡下的水溶液樣品中操作的特性,光鑷便因此被大量的應用於生物力的量測。這類的量測通常會先利用玻璃 (glass)、二氧化矽 (silica)、或聚苯乙烯 (polystyrene) 材質的圓形微粒子 (microsphere, or bead),量測出系統的光彈性係數。接著把欲量測的生物分子塗覆 (coat) 於微粒子上,接著再用光鑷捕捉及操控這些已塗覆生物分子的微粒子去黏附另一生物體或生物分子。最後,當我們把這些微粒子從另一生物體或生物分子上拉開時,就可以測得生物力或是生物黏附力了 ( 圖五 )。這種方式的優點在於,光鑷對於這類的圓形微粒子捕捉力最大,且對於不同大小、不同材質的圓形微粒子的光鑷彈性係數可以預先被量測出來,並且相對於不規則形狀的生物體如細胞,光鑷彈性係數也更準確。最後,再搭配上雙光點或多光點光鑷,使得我們可以對力量測有更多的彈性及準確性 ( 圖六 )。
 結語與展望
結語與展望
利用雷射來操控微粒子可以說是一個非常驚奇的發明。本文提到許多它在生物系統上的應用,但別忘了光鑷在物理的領域也有很大的貢獻,1997 年時的諾貝爾物理獎就是頒發給「發展利用雷射冷卻捕獲原子的方法」,其中為了捕捉原子也需要利用到光鑷的概念,而當年的得主之一朱棣文博士就曾經與 Arthur Ashkin 從事光鑷的工作 1。光鑷可說是因為在物理與生物界的貢獻,而兩次獲得諾貝爾獎 1。
光鑷不僅是在物理理論上有卓越的貢獻,在系統本身的發展也與現今許多工程上的進步有關,譬如在多光點以及全像光鑷中使用的空間光調變器或是微陣列鏡片,已存在於幾乎現今每台電腦的螢幕或是投影機的後面。在單粒子追蹤系統中,為了有更快速更乾淨的訊號,許多電子零件與儀器也發展得更精密。這是一個令人興奮的結果,因為這是一個連結了我們周遭生活的科技發展與基礎科學研究的例子。
本文提到了微粒子在光鑷中的熱擾動,也被進一步發展成為了光子力顯微鏡 (photonic force microscope, PFM),它利用被捕捉的微粒子與周圍環境作用影響到微粒子的熱擾動,描繪出二維,甚至三維的形貌 41。類似的研究還有利用光鑷量測軟黏彈性材料 (soft viscoelastic material) 的機械特性,可以量測小到單分子尺寸的微觀流變 (microrheology),並且可以主動的選擇空間上的位置及具有很好的時間解析度 42。光鑷系統相對於其他許多顯微系統是簡單也非常容易整合的,例如螢光共振能量轉移(Förster resonance energy transfer, fluorescence resonance energy transfer, FRET)43,還有受激放射耗乏顯微術 (Stimulated emission depletion microscopy, STED) 等等 44。光鑷也漸漸的與醫學研究有關,例如最近的論文利用斑馬魚胚胎去了解血流速度與流動力對於癌細胞黏附於內皮細胞的影響,也利用了光鑷去研究血液動力學與癌細胞的細胞轉移的關係 45。光鑷也慢慢地整合到活體 (in vivo) 的研究,利用光鑷去搬動孵化 6 天的斑馬魚的耳石 (otoliths, ear stones),結果發現這樣的前庭刺激可以使斑馬魚尾巴擺動 46。從 1970 年 Arthur Ashkin 第一篇關於光鑷的論文發表算起,光鑷已經發展了將近 50年。本文雖然提到許多應用光鑷於生物系統的研究,但實際上這些只是冰山一角,還有更多的研究等待著讀者自己去發掘甚至去進行。光鑷的發展也並不止於它自己本身的研究與應用,在整個生醫光電、顯微鏡學的領域都有它的影子。例如它跟 4Pi 超高解析度顯微術,或是最近很熱門的層光顯微術 (Light sheet-based fluorescence microscopy, LSFM) 也都有些關係 47。在過去的這 20 年中,科學研究很明顯的已經是朝著跨領域的發展,我們可以看到很多物理或化學的研究發明都是與生物研究有關,2014 年諾貝爾化學獎的超高解析度顯微術是一個例子,這幾年很熱門的光遺傳學 (optogenetics):利用光來操控許多蛋白質的表現或細胞內信號的傳遞也是一個例子。我們不只期待這些令人興奮的研究會帶給我們生活上的衝擊,也期望我們的讀者可以參與其中。
參考文獻
1. Won, R. &Ashkin, A. How it all began. Nat. Photonics 5, 316–317 (2011).
2. Ashkin, A. Acceleration and Trapping of Particles by Radiation Pressure. Phys. Rev. Lett. 24, 156–159 (1970).
3. Ashkin, A. &Dziedzic, J. M. Optical Levitation by Radiation Pressure. Appl. Phys. Lett. 19, 283–285 (1971).
4. Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E. &Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Opt. Lett. 11, 288 (1986).
5. Coy, D. L., Wagenbach, M. &Howard, J. Kinesin Takes One 8-nm Step for Each ATP That It Hydrolyzes. J. Biol. Chem. 274, 3667–71 (1999).
6. Martínez, I. A., Campoy, S., Tort, M., Llagostera, M. &Petrov, D. A simple technique based on a single optical trap for the determination of bacterial swimming pattern. PLoS One 8, e61630 (2013).
7. Min, T. L. et al. High-resolution, long-term characterization of bacterial motility using optical tweezers. Nat. Methods 6, 831–835 (2009).
8. Ma, B. et al. Optical sorting of particles by dual-channel line optical tweezers. J. Opt. 14, 105702 (2012).
9. Applegate, R. W., Squier, J., Vestad, T., Oakey, J. &Marr, D. W. M. Optical trapping, manipulation, and sorting of cells and colloids in microfluidic systems with diode laser bars. Opt. Express 12, 4390 (2004).
10. Ozkan, M. et al. Optical Manipulation of Objects and Biological Cells in Microfluidic Devices. Biomed. Microdevices 5, 61–67 (2003).
11. Liao, G.-B., Bareil, P. B., Sheng, Y. &Chiou, A. One-dimensional jumping optical tweezers for optical stretching of bi-concave human red blood cells. Opt. Express 16, 1996 (2008).
12. Lyubin, E.V., Khokhlova, M. D., Skryabina, M. N. &Fedyanin, A. A. Cellular viscoelasticity probed by active rheology in optical tweezers. J. Biomed. Opt. 17, 101510 (2012).
13. Khokhlova, M. D. et al. Normal and system lupus erythematosus red blood cell interactions studied by double trap optical tweezers: direct measurements of aggregation forces. J. Biomed. Opt. 17, 025001 (2012).
14. Schwenger, W. J. &Higbie, J. M. High-speed acousto-optic shutter with no optical frequency shift. Rev. Sci. Instrum. 83, 083110 (2012).
15. Curtis, J. E. &Grier, D. G. Structure of Optical Vortices. Phys. Rev. Lett. 90, 133901 (2003).
16. Sinclair, G. et al. Assembly of 3-dimensional structures using programmable holographic optical tweezers. Opt. Express 12, 5475 (2004).
17. Tseng, S.-Y. &Hsu, L. Controlling the transverse momentum distribution of a light field via azimuth division of a hologram in holographic optical tweezers. Appl. Opt. 50, H62 (2011).
18. Curtis, J. E., Koss, B. A. &Grier, D. G. Dynamic holographic optical tweezers. Opt. Commun. 207, 169–175 (2002).
19. Dufresne, E. R., Spalding, G. C., Dearing, M. T., Sheets, S. A. &Grier, D. G. Computer-generated holographic optical tweezer arrays. Rev. Sci. Instrum. 72, 1810 (2001).
20. Vossen, D. L. J., van derHorst, A., Dogterom, M. &vanBlaaderen, A. Optical tweezers and confocal microscopy for simultaneous three-dimensional manipulation and imaging in concentrated colloidal dispersions. Rev. Sci. Instrum. 75, 2960–2970 (2004).
21. Lin, H.-C. &Hsu, L. Study of the Line Optical Tweezers Characteristics Using a Novel Method and Establishing a Model for Cell Sorting. Jpn. J. Appl. Phys. 48, 072502 (2009).
22. Tseng, S.-Y., Chi, S. &Hsu, L. Particle-sorting by optical pattern of line shapes. in Proceedings of SPIE (eds. Dholakia, K. &Spalding, G. C.) 5514, 687 (International Society for Optics and Photonics, 2004).
23. MacDonald, M. P., Spalding, G. C. &Dholakia, K. Microfluidic sorting in an optical lattice. Nature 426, 421–424 (2003).
24. Chiou, P. Y., Ohta, A. T. &Wu, M. C. Massively parallel manipulation of single cells and microparticles using optical images. Nature 436, 370–372 (2005).
25. Yang, S.-M. et al. Dynamic manipulation and patterning of microparticles and cells by using TiOPc-based optoelectronic dielectrophoresis. Opt. Lett. 35, 1959 (2010).
26. Florin, E.-L., Pralle, A., Stelzer, E. H. K. &Hörber, J. K. H. Photonic force microscope calibration by thermal noise analysis. Appl. Phys. A Mater. Sci. Process. 66, S75–S78 (1998).
27. Gittes, F. &Schmidt, C. F. Chapter 8 Signals and Noise in Micromechanical Measurements. Methods Cell Biol.55, 129–156 (1997).
更多精彩內容就在物理雙月刊雜誌中:
單本購買:https://www.books.com.tw/products/R030078976
一年份訂購:https://cashier.ecpay.com.tw/store/3rg26
電子雜誌訂購:https://ebook.hyread.com.tw/bookDetail.jsp?id=163393
、
1971 年時他利用光與重力的平衡,也可成功的捕捉 20 微米的粒子 3。重要的是,1986 年Arthur Ashkin 發現,利用一道強烈聚焦的光,則介電質微粒子 (dielectric particles) 不會因為光壓的關係被光推走,反而是被光拉至聚焦點 4。這項發現不僅奠定了單光束光鑷的基礎,也大大的展開了光鑷在生物系統的應用。因為,許多顯微鏡使用高數值孔徑 (numericalaperture, NA) 的物鏡,非常便於形成光鑷需要的條件,此外,許多生物物體的大小,正好就是在微米的範圍,也是非常適合被光鑷捕捉。光鑷的捕捉力與雷射的功率成正比,但即便用到高功率的雷射,一般來說,光鑷的最大捕捉力量就是約 100 皮牛頓 (piconewton,10-12 N) 的範圍。這個力量雖然不大,但足以用來量測許多生物世界中的力。譬如驅動蛋白可以輸出的力、許多分子馬達產生的力、細胞與細胞間的黏附力或一些細胞分子間的作用力等等,都屬於光鑷可以量測的範圍。
 光鑷在生物系統上的捕捉與操縱
光鑷在生物系統上的捕捉與操縱光鑷最一開始被廣泛的應用於細胞骨架馬達蛋白的研究上。這些細胞骨架馬達蛋白會沿著細胞骨架運輸有機質,與染色體分裂及細胞間訊號傳遞都息息相關。然而,若要觀察kinesin 這種驅動蛋白在微管 (microtubule) 上的物理特性,科學家一開始只能被動地等待在microtubule 上是否有 kinesin 的出現。此時,光鑷恰好就扮演了一個非常適合的工具。因為,我們可以將 kinesin 黏附於一個直徑為 1 微米的聚苯乙烯小球 (polystyrene bead) 上,並利用光鑷捕捉小球並把它放在微管,甚至是微管上特定的位置。如此,我們化被動為主動,可以決定想觀察的時間,位置等等。也因此,許多 kinesin 的物理特性可以被量測出。譬如每走一步大約是 8 奈米,它的最高速度在細胞外約 0.8 μm / s ,在細胞內甚至可達2 μm / s 等等 5。 當然,我們也可以利用光鑷將 DNA 打結、捕捉細菌並藉此量測其物理特性 6,7、甚至結合微流道來做細胞或微粒子的篩選 8–10。
 多光點光鑷與全像光鑷
多光點光鑷與全像光鑷前面提到利用光鑷捕捉及操控顯微鏡下的微小物體,自然地,科學家也就會想到是否可以同時產生多光點光鑷。首先,我們可以將一道雷射光一分為二,或是利用多台雷射在同一台顯微鏡下形成雙光點或多光點光鑷。事實上,當我們擁有雙光點光鑷時就已經可以得到許多應用,譬如可以量測紅血球的形變 11、黏彈性係數 (viscoelasticity) 12、甚至是直接量測兩個紅血球之間黏附力的大小等等 13。而這些研究,讓我們可以從物理特性的角度去了解許多紅血球相關的疾病 13,並幫助對這些疾病的治療。
當然,相較於引入多道光束,若我們可以利用一道雷射光,產生多於雙光點的光鑷,在系統的安排與應用上就會更加簡潔與彈性。於是,首先被提出來的方式,便是利用聲光調變器高速改變光束行進方向的特性,結合共軛焦顯微鏡相同的掃描概念,快速地將雷射光的焦點在多個位置上輪流停滯 14。利用這樣分享光束停留的時間,也可以等效地產生多個捕捉的位點。但是,這樣的方式也有明顯的缺點,就是由於在捕捉位點上的光場並不是持續存在,且存在的時間比例也會隨位點增加而減少,也就無法穩定地捕捉,也較不適用於對樣品快速響應的觀察 ( 圖一 A)。

圖一:多光點與全像光鑷 。A. 利用強度與相位調變光場的方式與優缺點:利用強度調變的光罩圖案設計比較直覺也簡單,但缺點是會浪費較多的光能量,利用相位調變的方式相位光罩圖案的設計雖然比較不直覺,但可以保留比較多的光能量。B. 全像光鑷的理論概念及系統架設圖 15,19。C. 全像光鑷在空間光調變器上的圖案與光鑷在焦平面上的分布的一例,下圖中為多個微粒子被這樣的光鑷捕捉並操控 17。D. 全像光鑷可同時捕捉多個微粒子,可以藉由電腦輸入各種圖案,並可做三維的操控( 右下角 )。如右下角圖所示,多顆微粒子被捕捉及操控在不同的平面 ( 縱軸位置 )18
為了突破這樣的限制,全像光鑷(holographic optical tweezers) 的概念便被提出來了 ( 圖一 )。從本質上來說,光鑷的捕捉力其實來自於光場的強弱變化,這也是這個力量被稱為是梯度力的原因。只要能夠改變雷射光場的空間分布,便可以達成更多樣的捕捉方式。因此,利用相位光罩或是空間光調變器 (spatial light modulator) 對雷射的光場相位進行調變,進而產生多光點光鑷的研究於焉產生 15–19。簡單的說,當雷射光的橫向光場的相位,受到全像光罩或是空間光調變器的調變,再經過光學系統後,便會彼此干涉,而可創造出各種強度變化的雷射光場,也就形成不同形式的光鑷 ( 圖一 B)。而這種利用相位調變與干涉的方法,相對直接用光罩去遮蓋或分光,不僅可以減少光能量在整個系統中的損失,也可以彈性的創造出更複雜的光場形貌 ( 圖一 A)。其中,空間光調變器可以利用電腦直接產生圖形,於是,我們可以將空間光調變器放置於顯微鏡物鏡後焦平面的共軛平面上 ( 圖一 B),即時改變顯示在空間光調變器上的圖形,則可以即時改變多光點光鑷的位置,甚至可以達到三維的調控 ( 圖一 D)16,20。這類的研究還有更多的發展,也促成了許多光學理論的發展 15,17( 圖一 C),以及光學工程上的進展。譬如可以產生線型的光鑷 21,22;或是光學漩渦(optical vortex) 這樣具備角動量光場 15,可以在不改變光場分布就可以推動捕捉粒子的光鑷等等。
 利用光鑷與光電鑷夾於篩選與分類的應用
利用光鑷與光電鑷夾於篩選與分類的應用既然光鑷可以捕捉微粒子,甚至可以形成多光點或是其他特殊形狀的光鑷,自然地,科學家也就想要利用它與微流道,做為微粒子,甚至生物體如細胞篩選 (sorting) 的工具 (圖二 )。譬如,當微粒子因為大小或特性不同,而與光鑷的交互作用力不同時被分離、或是當有目標微粒子經過時,主動地利用影像辨識,開啟或關閉光鑷、或是利用線形或其他形狀的光鑷,使得目標微粒子被光鑷改變方向或是沿著光鑷的方向而被引導至某一個微流道而達到篩選的目的 8,22,23。除此之外,以光鑷作為篩選的方法也激發了其他利用光來篩選微粒子的方法,例如光電鑷夾 (圖二B、C)24。其原理來自於在非均勻電場中的介電質微粒子,會因為與電場而產生誘導偶極,並因誘導偶極與電場相互作用,而產生力將微粒子吸引或推開。因此,若製作一個類似三明治結構的介電泳 (Dielectrophoresis,DEP) 晶片,上下層為氧化銦錫 (ITO) 材料,中間則可以注入微粒子或設計成微流道結構。接著,再次利用空間光調變器,或是微陣列鏡片 (DMD) 產生需要的圖案,並將這樣的圖案投影到介電泳晶片上,便可以產生跟設計的圖案一樣的光電鑷夾,用以捕捉、操控、或篩選微粒子 24,25。

圖二:應用光鑷與光電鑷夾進行篩選與分類示意圖。A. 利用晶格 (optical lattice) 光鑷來分類大小不同的微粒子:當微粒子由右邊流向左邊時,2 微米的微粒子會被引導向上,而 4 微米的粒子則不受影響繼續朝左 23。B. 利用活細胞與死細胞內的離子濃度不同造成介電係數不同而被光電鑷夾分離 24。C. 利用 DMD 操控光電鑷夾主動篩選及分離微粒子 25。
光電鑷夾有幾個很大的好處,例如:它可以不需要雷射光,只需要非同調性且低能量的光,便可以進行操作。而且,其產生的電場力量遠大於光鑷的捕捉力。當然,如前面所述,這樣的設計也可以即時的改變電場的圖形,亦即達到即時的操控。
 光鑷的力量測與單粒子追蹤系統
光鑷的力量測與單粒子追蹤系統光鑷捕捉力的行為就像是一個彈簧作用力一樣,當被捕捉的微粒子越遠離捕捉平衡中心時,捕捉力越強 ( 圖三 A)。其中,捕捉力與微粒子距離捕捉中心的距離有一個光鑷彈性係數 kOT 。最簡單的光鑷捕捉力的量測莫過於是水流黏滯力量測法了。基本上,利用水流去沖刷被捕捉的微粒子,微粒子受到水的黏滯力被沖離開捕捉中心,但當離開捕捉中心越遠也會有越強的捕捉力將其拉回捕捉中心,直到兩力達到平衡。所以,若改變幾個不同的水流速度,並量測這幾個靜力平衡下時微粒子被沖離捕捉中心的位移,即可以得到黏滯力( 也就是捕捉力 ) 與微粒子位移的關係,也就求得了光鑷彈性係數 ( 圖三 B)。其現象如同方程式 (1) 所描述,
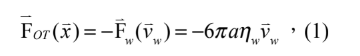
其中,
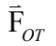 為光鑷捕捉力、
為光鑷捕捉力、 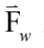 為水流黏滯力、 a 為微粒子半徑、
為水流黏滯力、 a 為微粒子半徑、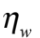 為水流黏滯係數、
為水流黏滯係數、 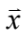 為微粒子與捕捉中心的位移、
為微粒子與捕捉中心的位移、 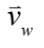 為水流速度,而
為水流速度,而 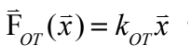
然而,若微觀來看,在水溶液中,微粒子會因與溶液碰撞,而產生熱擾動的行為與現象 ( 圖三 C)。且當微粒子越小,熱擾動的行為也就越劇烈,即便被光鑷捕捉,此一熱擾動還是存在,只是被限制在光鑷捕捉陷阱範圍中。因此除了水流黏滯力量測法,我們也可以偵測微粒子在光鑷中的熱擾動,透過波茲曼統計 (Boltzmann statistics),回推出光鑷捕捉陷阱的能量,也就可以得到光鑷彈性係數 ( 圖三 C)26。詳細來說,微粒子在一個能量井中的
各個位置出現的機率為:
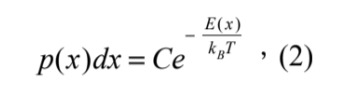
其中 p(x)dx 代表熱平衡下, E(x) 這個能量井中 dx 範圍內找到這個微粒子的機率、kB為波茲曼常數、T 為溫度 (凱氏溫標K)、C 為歸一化常數使得 ∫ p(x)dx = 1。能量井也就為:
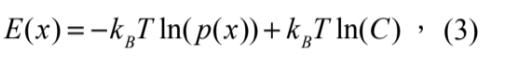
且可對比為一彈簧模型:
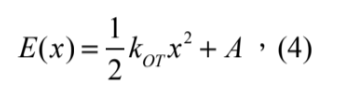
其中 kOT 為光鑷彈性係數, A 為常數。
我們也可以把微粒子在光鑷中的熱擾動行為進行功率頻譜分析 (power spectrumanalysis),量測出功率譜密度曲線的截止頻率 (cut-off frequency) 即可得到光鑷彈性係數 (圖三 C)27,28。從微觀來看,一個於溶液中被光鑷捕捉的微粒子,因其質量、尺寸大小與環境黏滯所得之雷諾數 (Reynolds number) 很小的緣故,熱擾動作用力
 、光鑷捕捉力
、光鑷捕捉力 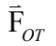 與水流黏滯力
與水流黏滯力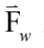 幾乎隨時是平衡的,故
幾乎隨時是平衡的,故 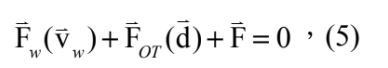
而其簡化之一維朗之萬方程式 (Langevin equation) 可表示為:
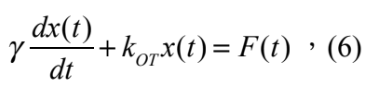
其中 γ = 6πaη w 。將式 (6) 等號兩側取傅立葉轉換則可得到:
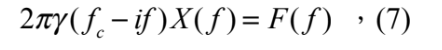
其中 F( f ) 與 X( f ) 分別為 F(t) 與 x(t) 的傅立葉轉換, F( f ) = F{F(t)}、 X( f ) = F{x(t)},而 fc = kOT / 2πγ 為截止頻率。再將式 (7) 左右兩側都取絕對值平方,也就是功率頻譜,
則可得到:
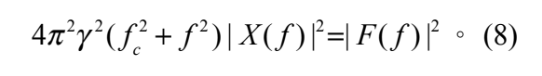
微粒子被光鑷捕捉的捕捉過程中,熱擾動相當的隨機,也就是 F(t) 在一個長時間內的平均為零 ( 相當於回到巨觀來看,( F(t) = 0 ),且其功率頻譜由愛因斯坦關係可得
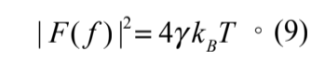
將式 (9) 代回式 (8) 則我們可以得到:
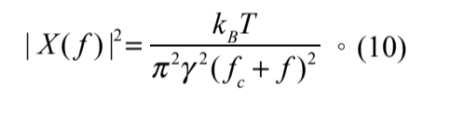
總結來說,我們觀察一被光鑷捕捉的微粒子的熱擾動現象一段時間後,利用式 (4) 線性回歸至波茲曼統計的結果,或式 (10) 線性回歸至功率頻譜分析,即可獲得光鑷彈性係數( 圖三 C)。然而為了偵測微粒子的熱擾動,直接觀察微粒子的亮視野影像並沒有辦法那麼精確。這主要是受到物鏡放大率的限制,一般而言,攝影機 (CCD Camera) 無法解析微粒子的位置達到十奈米以下的解析度。因此,可以更精確量測微粒子位移的單粒子追蹤系統(single particle tracking system) 也就被開發出來 ( 圖四 )29–31。在光鑷的領域中,我們可以量測雷射打到微粒子產生的前向或背向散射光 (forward or backward scattering light),或是與沒有被微粒子散射與散射光的互相作用的干涉光 29,31。量測的方式是將一個四象限光偵測器 (quadrant photodetector ),放置於產生光鑷的物鏡,或是另一個在原本物鏡對向的偵測物鏡的後焦平面上來偵測散射或干涉光斑 ( 圖四 )。如此,我們不僅可以偵測微粒子的位置達到只有幾個奈米 (nm) 的解析度,且可以達到 MHz 的時間解析度。為了能真正精確偵測量出微粒子的位置,有許多關於單粒子追蹤系統的細節的研究 29,30,譬如微粒子的大小與物鏡數值孔徑的組合會影響到偵測位置的線性關係與適用範圍 29。另外,藉由在系統中加入另一道偵測雷射,並調整這道雷射的聚焦光點,對於適用於偵測的微粒子尺寸大小可以更彈性,也更可以優化偵測位置的靈敏度及線性範圍 30。

圖三:光鑷彈性係數量測。A. 光鑷本身為一三維位能井,其在 x,y,z 方向的光鑷彈性係數都會有一點不同。B. 水流黏滯力量測法:利用水流沖刷被捕捉的微粒子,量測微粒子被沖離原來捕捉中心的距離以量測出光鑷彈性係數。C. 觀察被捕捉的微粒子的熱擾動,透過波茲曼統計 (Boltzmann statistics)26 或功率頻譜分析 (power spectrum analysis)28,得到出光鑷彈性係數。

圖四:單粒子追蹤系統。利用雷射光打到微粒子產生的背向或前向散射光,或是後者與未散射的干涉光斑來偵測微粒子的位置。QPD (Quadrant photodetector,四象限光偵測器 ) 偵測x,y,z位置之原理如圖示。QPD1可用來觀察前向散射光而QPD2可用來觀察背向散射光。散射或干涉光可以來自光鑷捕捉雷射或另一道偵測雷射。右圖為一被光鑷捕捉的微粒子的三維熱擾動。
利用微粒子熱擾動量測光鑷的捕捉力還有一個好處,就是它可以同時量測出光鑷三維的光彈性係數,因為光鑷本身就是一個三維的位能井,而縱向的光彈性係數很容易被忽略,且在過去利用水黏滯力量測法也是非常難辦到的。能夠獲得三維的光彈性係數,也使得應用光鑷於生物力的量測可以更精確了 31。
 應用光鑷於生物力的量測
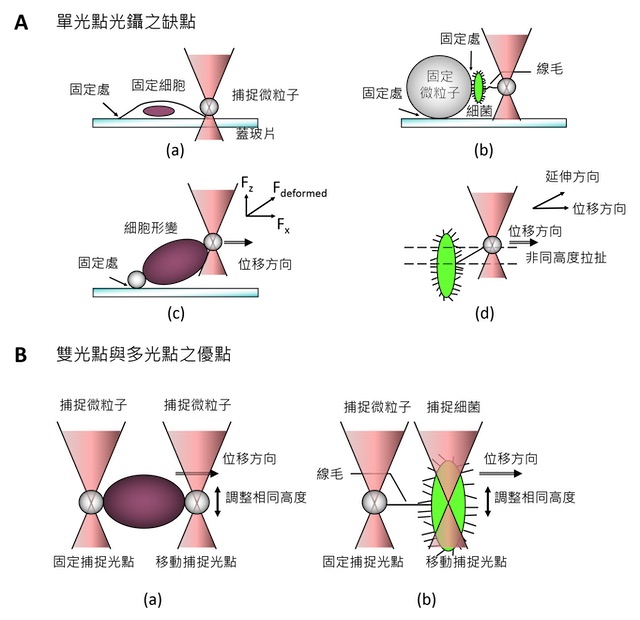
應用光鑷於生物力的量測藉由前述的光鑷彈性係數量測,並量測微粒子與捕捉中心的位移,便可以獲得目前施加在微粒子上的力。結合可以簡單地在顯微鏡下的水溶液樣品中操作的特性,光鑷便因此被大量的應用於生物力的量測。這類的量測通常會先利用玻璃 (glass)、二氧化矽 (silica)、或聚苯乙烯 (polystyrene) 材質的圓形微粒子 (microsphere, or bead),量測出系統的光彈性係數。接著把欲量測的生物分子塗覆 (coat) 於微粒子上,接著再用光鑷捕捉及操控這些已塗覆生物分子的微粒子去黏附另一生物體或生物分子。最後,當我們把這些微粒子從另一生物體或生物分子上拉開時,就可以測得生物力或是生物黏附力了 ( 圖五 )。這種方式的優點在於,光鑷對於這類的圓形微粒子捕捉力最大,且對於不同大小、不同材質的圓形微粒子的光鑷彈性係數可以預先被量測出來,並且相對於不規則形狀的生物體如細胞,光鑷彈性係數也更準確。最後,再搭配上雙光點或多光點光鑷,使得我們可以對力量測有更多的彈性及準確性 ( 圖六 )。

圖五:光鑷之生物力量測實例:細菌纖毛黏附力的量測。利用光鑷捕捉塗覆著膠原蛋白、直徑為1 微米的圓形微粒子 (A);並操縱移動使其黏附於細菌纖毛上 (B);接著利用光鑷拉離細菌 (C、D)。此時,隨著拔離的距離越大,光鑷便會如彈簧一般產生越大的力,直至光鑷捕捉力大於纖毛黏附力而將微粒子拔離開纖毛 (E)。圖中左邊縱軸代表的是 QPD 量測到的電壓,可以換算出實際位移以及光鑷捕捉力 ( 右邊縱軸 )。(A) 及 (E) 的電壓與位移變化便顯示微粒子在光鑷中的熱擾動。
以前面所提到的 kinesin 於微管上的運動來說,除了位移的運動行為外,我們也可以量測出 kinesin 每走一步的力量大約是 5 pN32。再以生物細胞中最重要的分子 DNA 為例,許多生物過程都藉由酵素在 DNA 上活動的方式進行,而這樣的運動卻也會遭受到 DNA上的結合蛋白或 DNA 的超螺旋結構所阻礙。若將其視為是一種 DNA 之間的摩擦力,則可以量出其大小為 1 pN33。 而在 DNA 轉錄為 RNA 的過程中,所參與的主要酵素- RNA聚合酶在不同物種間的力量大小與差異也可以被分辨與量測出來 34。從更基本的角度,藉由直接拉扯 DNA 分子,也可以對其高分子的物理機械特性有更清楚地了解 35。除了細胞內的分子行為,對於細胞外部的胞器特性,也同樣可以進行更深入的了解。例如細菌單一纖毛結構以及其對膠原蛋白間的黏附力,也可以利用光鑷進行量測與分辨 36,37。細胞與細胞、或是細胞與細胞外間質間的黏附力也是令人關心與重要的課題 38–40。更精確地說,有些黏附力的形成是在細胞膜上的整合素與細胞外間質的交互作用 38。而細胞的絲狀偽足 (filopodia) 可以感受周圍的環境,然後引發一連串的傳遞訊號至細胞內,與細胞的移動(cell migration) 或是細胞黏附力有很大的關係 39。還有細胞內骨架與細胞外環境的訊號傳遞也會形成非常動態的細胞局部黏附 (focal adhesion),接著影響到細胞的牽引力 (cellulartraction forces) 40。

圖六:雙光點及多光點光鑷應用於生物力量測之優點。A. 單光點光鑷於生物力量測之應用限制:光鑷捕捉之微粒子需避免過於接近樣品玻片表面,以避免玻片黏附與表面黏滯度變化影響。對於(a) 貼附於玻片上的細胞,或是 (b) 先將其黏附於另一微小球上,則可能造成量測錯誤與 (c)(d) 斜向量測的情況。B. 若以雙光點或多光點光鑷,則可同時捕捉兩個黏附於生物體的微小球,並於較
遠離玻片之同一高度進行量測。
遠離玻片之同一高度進行量測。
 結語與展望
結語與展望利用雷射來操控微粒子可以說是一個非常驚奇的發明。本文提到許多它在生物系統上的應用,但別忘了光鑷在物理的領域也有很大的貢獻,1997 年時的諾貝爾物理獎就是頒發給「發展利用雷射冷卻捕獲原子的方法」,其中為了捕捉原子也需要利用到光鑷的概念,而當年的得主之一朱棣文博士就曾經與 Arthur Ashkin 從事光鑷的工作 1。光鑷可說是因為在物理與生物界的貢獻,而兩次獲得諾貝爾獎 1。
光鑷不僅是在物理理論上有卓越的貢獻,在系統本身的發展也與現今許多工程上的進步有關,譬如在多光點以及全像光鑷中使用的空間光調變器或是微陣列鏡片,已存在於幾乎現今每台電腦的螢幕或是投影機的後面。在單粒子追蹤系統中,為了有更快速更乾淨的訊號,許多電子零件與儀器也發展得更精密。這是一個令人興奮的結果,因為這是一個連結了我們周遭生活的科技發展與基礎科學研究的例子。
本文提到了微粒子在光鑷中的熱擾動,也被進一步發展成為了光子力顯微鏡 (photonic force microscope, PFM),它利用被捕捉的微粒子與周圍環境作用影響到微粒子的熱擾動,描繪出二維,甚至三維的形貌 41。類似的研究還有利用光鑷量測軟黏彈性材料 (soft viscoelastic material) 的機械特性,可以量測小到單分子尺寸的微觀流變 (microrheology),並且可以主動的選擇空間上的位置及具有很好的時間解析度 42。光鑷系統相對於其他許多顯微系統是簡單也非常容易整合的,例如螢光共振能量轉移(Förster resonance energy transfer, fluorescence resonance energy transfer, FRET)43,還有受激放射耗乏顯微術 (Stimulated emission depletion microscopy, STED) 等等 44。光鑷也漸漸的與醫學研究有關,例如最近的論文利用斑馬魚胚胎去了解血流速度與流動力對於癌細胞黏附於內皮細胞的影響,也利用了光鑷去研究血液動力學與癌細胞的細胞轉移的關係 45。光鑷也慢慢地整合到活體 (in vivo) 的研究,利用光鑷去搬動孵化 6 天的斑馬魚的耳石 (otoliths, ear stones),結果發現這樣的前庭刺激可以使斑馬魚尾巴擺動 46。從 1970 年 Arthur Ashkin 第一篇關於光鑷的論文發表算起,光鑷已經發展了將近 50年。本文雖然提到許多應用光鑷於生物系統的研究,但實際上這些只是冰山一角,還有更多的研究等待著讀者自己去發掘甚至去進行。光鑷的發展也並不止於它自己本身的研究與應用,在整個生醫光電、顯微鏡學的領域都有它的影子。例如它跟 4Pi 超高解析度顯微術,或是最近很熱門的層光顯微術 (Light sheet-based fluorescence microscopy, LSFM) 也都有些關係 47。在過去的這 20 年中,科學研究很明顯的已經是朝著跨領域的發展,我們可以看到很多物理或化學的研究發明都是與生物研究有關,2014 年諾貝爾化學獎的超高解析度顯微術是一個例子,這幾年很熱門的光遺傳學 (optogenetics):利用光來操控許多蛋白質的表現或細胞內信號的傳遞也是一個例子。我們不只期待這些令人興奮的研究會帶給我們生活上的衝擊,也期望我們的讀者可以參與其中。
參考文獻
1. Won, R. &Ashkin, A. How it all began. Nat. Photonics 5, 316–317 (2011).
2. Ashkin, A. Acceleration and Trapping of Particles by Radiation Pressure. Phys. Rev. Lett. 24, 156–159 (1970).
3. Ashkin, A. &Dziedzic, J. M. Optical Levitation by Radiation Pressure. Appl. Phys. Lett. 19, 283–285 (1971).
4. Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E. &Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Opt. Lett. 11, 288 (1986).
5. Coy, D. L., Wagenbach, M. &Howard, J. Kinesin Takes One 8-nm Step for Each ATP That It Hydrolyzes. J. Biol. Chem. 274, 3667–71 (1999).
6. Martínez, I. A., Campoy, S., Tort, M., Llagostera, M. &Petrov, D. A simple technique based on a single optical trap for the determination of bacterial swimming pattern. PLoS One 8, e61630 (2013).
7. Min, T. L. et al. High-resolution, long-term characterization of bacterial motility using optical tweezers. Nat. Methods 6, 831–835 (2009).
8. Ma, B. et al. Optical sorting of particles by dual-channel line optical tweezers. J. Opt. 14, 105702 (2012).
9. Applegate, R. W., Squier, J., Vestad, T., Oakey, J. &Marr, D. W. M. Optical trapping, manipulation, and sorting of cells and colloids in microfluidic systems with diode laser bars. Opt. Express 12, 4390 (2004).
10. Ozkan, M. et al. Optical Manipulation of Objects and Biological Cells in Microfluidic Devices. Biomed. Microdevices 5, 61–67 (2003).
11. Liao, G.-B., Bareil, P. B., Sheng, Y. &Chiou, A. One-dimensional jumping optical tweezers for optical stretching of bi-concave human red blood cells. Opt. Express 16, 1996 (2008).
12. Lyubin, E.V., Khokhlova, M. D., Skryabina, M. N. &Fedyanin, A. A. Cellular viscoelasticity probed by active rheology in optical tweezers. J. Biomed. Opt. 17, 101510 (2012).
13. Khokhlova, M. D. et al. Normal and system lupus erythematosus red blood cell interactions studied by double trap optical tweezers: direct measurements of aggregation forces. J. Biomed. Opt. 17, 025001 (2012).
14. Schwenger, W. J. &Higbie, J. M. High-speed acousto-optic shutter with no optical frequency shift. Rev. Sci. Instrum. 83, 083110 (2012).
15. Curtis, J. E. &Grier, D. G. Structure of Optical Vortices. Phys. Rev. Lett. 90, 133901 (2003).
16. Sinclair, G. et al. Assembly of 3-dimensional structures using programmable holographic optical tweezers. Opt. Express 12, 5475 (2004).
17. Tseng, S.-Y. &Hsu, L. Controlling the transverse momentum distribution of a light field via azimuth division of a hologram in holographic optical tweezers. Appl. Opt. 50, H62 (2011).
18. Curtis, J. E., Koss, B. A. &Grier, D. G. Dynamic holographic optical tweezers. Opt. Commun. 207, 169–175 (2002).
19. Dufresne, E. R., Spalding, G. C., Dearing, M. T., Sheets, S. A. &Grier, D. G. Computer-generated holographic optical tweezer arrays. Rev. Sci. Instrum. 72, 1810 (2001).
20. Vossen, D. L. J., van derHorst, A., Dogterom, M. &vanBlaaderen, A. Optical tweezers and confocal microscopy for simultaneous three-dimensional manipulation and imaging in concentrated colloidal dispersions. Rev. Sci. Instrum. 75, 2960–2970 (2004).
21. Lin, H.-C. &Hsu, L. Study of the Line Optical Tweezers Characteristics Using a Novel Method and Establishing a Model for Cell Sorting. Jpn. J. Appl. Phys. 48, 072502 (2009).
22. Tseng, S.-Y., Chi, S. &Hsu, L. Particle-sorting by optical pattern of line shapes. in Proceedings of SPIE (eds. Dholakia, K. &Spalding, G. C.) 5514, 687 (International Society for Optics and Photonics, 2004).
23. MacDonald, M. P., Spalding, G. C. &Dholakia, K. Microfluidic sorting in an optical lattice. Nature 426, 421–424 (2003).
24. Chiou, P. Y., Ohta, A. T. &Wu, M. C. Massively parallel manipulation of single cells and microparticles using optical images. Nature 436, 370–372 (2005).
25. Yang, S.-M. et al. Dynamic manipulation and patterning of microparticles and cells by using TiOPc-based optoelectronic dielectrophoresis. Opt. Lett. 35, 1959 (2010).
26. Florin, E.-L., Pralle, A., Stelzer, E. H. K. &Hörber, J. K. H. Photonic force microscope calibration by thermal noise analysis. Appl. Phys. A Mater. Sci. Process. 66, S75–S78 (1998).
27. Gittes, F. &Schmidt, C. F. Chapter 8 Signals and Noise in Micromechanical Measurements. Methods Cell Biol.55, 129–156 (1997).
更多精彩內容就在物理雙月刊雜誌中:
單本購買:https://www.books.com.tw/products/R030078976
一年份訂購:https://cashier.ecpay.com.tw/store/3rg26
電子雜誌訂購:https://ebook.hyread.com.tw/bookDetail.jsp?id=163393
、